Título
Autor
Fecha
Lugar de Realización
Correspondencia
Texto
Rev. argent. neurocir. v.21 n.4 Ciudad Autónoma de Buenos Aires oct./dic. 2007
Localización del surco central en pacientes con tumores cerebrales cercanos a la corteza sensitivo-motora utilizando Omega contralateral
Alvaro Campero1,2,3, Carolina Martins3, Juan Emmerich4, Alexandre Yasuda3, Mariano Socolovsky2 y Rafael Torino2
1 Servicio de Neurocirugía, Hospital Zenón Santillán, Tucumán, Argentina
2 Servicio de Neurocirugía, Hospital Británico de Buenos Aires, Buenos Aires, Argentina;
3 Department of Neurological Surgery, University of Florida, Gainesville, Florida;
4 Cátedra de Anatomía, Facultad de Ciencias Médicas, Universidad Nacional de la Plata, La Plata, Argentina.
Correspondencia: Av. Sarmiento 45, 3 "C" (4000) Tucumán -Argentina alvarocampero@yahoo.com.ar
Recibido: julio 2007; aceptado: septiembre 2007
RESUMEN
Objetivo. Determinar la utilidad de la identificación del surco central contralateral a la lesión, a través de Omega invertida, como método para localizar la corteza sensitivomotora adyacente al proceso tumoral.
Método. Desde julio de 2005 hasta abril de 2007, fueron operadas por el primer autor (AC) 15 pacientes con lesiones cercanas o a nivel de la corteza sensitivomotora, utilizando el signo de Omega contralateral a la lesión. Además, fueron estudiados 5 cerebros (10 hemisferios) de cadáveres adultos fijados en formol.
Resultados. El surco central separa la corteza motora de la sensitiva. Presenta tres rodillas o curvas. La rodilla media, es la responsable de la forma de Omega invertida que muestra el surco central en un corte axial. En promedio, la altura de Omega fue de 11,2 mm ± 3,35 mm, y el ancho, en su base, de 18,7 mm ± 2,49 mm. Por otro lado, la distancia promedio desde el borde medial de Omega hasta la línea media fue de 24,5 mm ± 5,35 mm. En los 15 casos se estudió detenidamente la Resonancia Magnética (corte axial) antes de la cirugía, para poder identificar el surco central a través del signo de Omega, en el hemisferio contralateral a la lesión. En todos los casos excepto uno, fue posible identificar dicho signo. De los quince pacientes operados, siete mostraron déficit motor previo a la cirugía (1 plejía, 1 paresia severa, 1 paresia moderada y 4 paresias leves). En todos los casos hubo una mejoría en el postoperatorio. Los ocho pacientes restantes no presentaron déficit motor antes de la cirugía. Luego del procedimiento quirúrgico, dichos enfermos continuaron sin presentar déficit motor.
Conclusión. El signo de Omega contralateral puede, fácil y eficientemente, ser utilizado para identificar la relación entre una lesión y el surco central ipsilateral.
Palabras clave: Anatomía; Omega; Resonancia magnética; Surco central.
ABSTRACT
Objective. To determine the utility of the contralateral central sulcus identification, by the inverted omega-shaped, as a method to localize the sensorimotor cortex adjacent to the tumoral process.
Method. From July 2005 to April 2007, 15 patients with lesions near or over the sensorimotor cortex were operated, using the Omega sign contralateral to the lesion. Furthermore, 5 formalinfixed brains (10 hemispheres) were studied.
Results. The central sulcus separates the motor from the sensitive cortex. It presents three genua. The middle genus is the responsible of the inverted omega-shape that shows the central sulcus in an axial cut. On average, the Omega's height was 11,2 mm ± 3,35 mm, and its breadth, in the base, was 18,7 mm ± 2,49 mm. Additionally, the average distance from omega to midline was 24,5 mm ± 5,35 mm. In all the 15 surgical cases except in one it was possible to identify the central sulcus using the Omega sign. Of the 15 operated patients, seven showed motor deficit before surgery. All those patients showed improvement after the procedure. The other eight patients did not present motor weakness preoperatively, neither presented motor deficit after the surgery.
Conclusion. The contralateral omega sign can easyly and reliably be used to identify the relationships between the lesion and the central sulcus.
Key words: Anatomy; Central sulcus; Magnetic resonance; Omega.
INTRODUCCIÓN
En la selección de los pacientes para realizar una craneotomía, el riesgo de un déficit neurológico postoperatorio, como resultado de un daño cerebral en un área elocuente, debe ser evaluado previo a la cirugía1. La localización del surco central es esencial en la planificación neuroquirúrgica para el tratamiento de lesiones adyacentes a la corteza primaria sensitivomotora2. Así, una de las formas de localizar el surco central es a través de la protrusión que forma el giro precentral en el sector superior de dicho surco, representado por la forma de una letra Omega invertida3 (Fig. 1). Sin embargo, definir la anatomía cerebral en base a reparos estructurales puede no ser útil si la lesión cerebral ha distorsionado la anatomía cerebral local4.
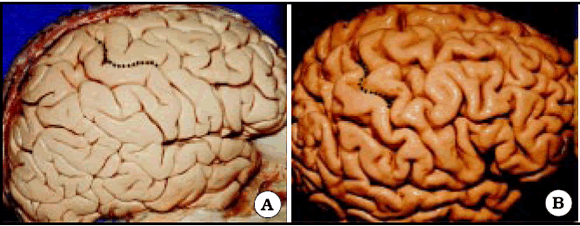
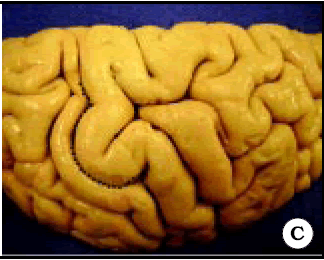
Fig. 1. Vista de tres hemisferios derechos en preparados anatómicos. A, B y C, Omega está representada por una línea de puntos de color negro. Note la diferencia de forma de Omega entre los diferentes especimenes.
Es el objetivo del presente trabajo determinar la utilidad de la identificación del surco central contralateral a la lesión, a través de Omega invertida, como método para localizar la corteza sensitivomotora adyacente al proceso tumoral.
PACIENTES Y MÉTODO
Desde julio de 2005 hasta abril de 2007, fueron operadas 15 pacientes con lesiones cercanas o a nivel de la corteza sensitivomotora por el primer autor (AC) (Tabla 1) (Figs. 4-10). Dichas lesiones fueron: 7 metástasis, 5 meningiomas y 3 gliomas, y se describen en mayor detalle en el cuadro 1. Antes de realizar la cirugía, se intentó identificar el surco central contralateral a la lesión utilizando el signo de la letra Omega invertida, en un corte axial de resonancia magnética.
Tabla 1. Resumen de los pacientes operados
Además, fueron estudiados 5 cerebros (10 hemisferios) de cadáveres adultos, fijados en formol. Las mediciones se realizaron con un calibre (exactitud de 0,02 mm. Draper, Japón).
RESULTADOS
Surco central y Omega
El surco central, también conocido como cisura de Rolando, separa la corteza motora de la sensitiva, y el lóbulo frontal del parietal. Desde su extremo superior, tiene una dirección anterior, inferior y lateral. Presenta flexuosidades en su recorrido, llamadas rodillas. Se pueden distinguir tres rodillas: una rodilla superior, una rodilla media y una rodilla inferior; la superior y la inferior son convexas hacia delante y la media es convexa hacia atrás. La rodilla superior es la más pequeña de todas. La rodilla media, que es más pronunciada en profundidad, es la responsable de la forma de Omega invertida que muestra el surco central en un corte axial (Figs. 1 y 2). Dicho signo se encuentra a un mismo nivel transversal en ambos lados (Fig. 2 C).
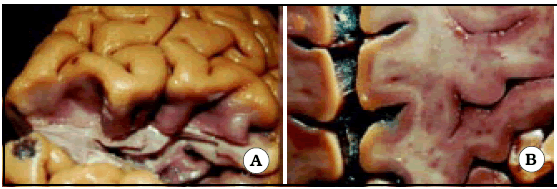
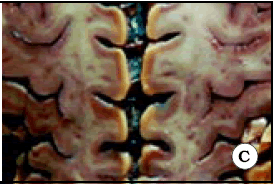
Fig. 2. A. El giro postcentral ha sido resecado para observar el giro precentral desde atrás. Note la protrusión que hace el giro precentral hacia atrás, a nivel de la rodilla media del surco central. Dicha protrusión es la responsable del signo de Omega en un corte axial. B. El hemisferio derecho ha sido seccionado en forma axial para observar Omega en un preparado anatómico. C. Vista de un corte axial en ambos hemisferios cerebrales. Note que Omega de ambos lados se ubican a un mismo nivel anteroposterior, hecho que sirve para utilizar Omega contralateral a la lesión cuando la anatomía ipsilateral se encuentra distorsionada por el proceso tumoral.
Mediciones de Omega
Se realizaron mediciones en 10 hemisferios cerebrales, a nivel de la superficie cortical. En promedio, la altura de Omega fue de 11,2 mm ± 3,35 mm, y el ancho, en su base, de 18,7 mm ± 2,49 mm. Por otro lado, la distancia promedio desde el borde medial de Omega hasta la línea media fue de 24,5 mm ± 5,35 mm (Tabla 2) (Fig. 3).
Tabla 2. Medidas de Omega

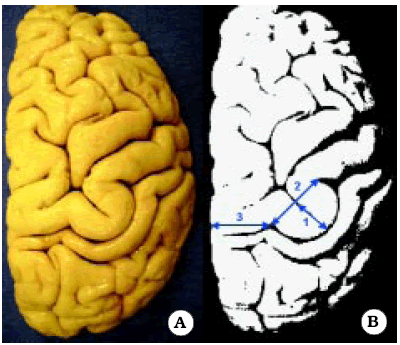
Fig. 3. Vista superior del signo de Omega en un hemisferio derecho. A. Foto de un preparado anatómico. B. Esquema del mismo preparado para mostrar las mediciones que se realizaron en el presente estudio.
Localización de Omega contralateral
En los 15 casos se estudió detenidamente la resonancia magnética (corte axial) antes de la cirugía, para poder identificar el surco central a través del signo de Omega, en el hemisferio contralateral a la lesión. En todos los casos excepto uno, fue posible identificar dicho signo (Figs. 4-6, 8-10). En el caso que no fue posible identificar Omega, el paciente presentaba una metástasis de cáncer de pulmón en el hemisferio derecho, y en el hemisferio contralateral, sano, presentaba un quiste aracnoideo que alteraba la anatomía. Sin embargo, en dicho paciente fue de utilidad el corte sagital, donde se pudo identificar el surco central en el hemisferio de la lesión, gracias a la típica forma de gancho dirigido hacia atrás del giro precentral (Fig. 7)3.
<
Fig. 4. Caso 1. Paciente mujer de 29 años con diagnóstico por anatomía patológica de astrocitoma grado II. A, corte axial de RM mostrando el tumor a nivel del giro frontal superior derecho. En el lado contralateral está representada Omega por una línea de puntos de color amarillo. B, corte sagital de RM mostrando el tumor. C, foto intraoperatoria antes de resecar el tumor. D, foto intraoperatoria luego de resecar el tumor. E, corte axial de RM luego de la cirugía, mostrando una resección macroscópicamente completa. F, corte sagital de RM luego de la cirugía. G, foto de la paciente luego de la cirugía, sin foco motor.
Resultados quirúrgicos
Los quince pacientes fueron operados a través de una craneotomía clásica, con la utilización de técnicas microquirúrgicas (Figs. 4-10). Luego de pasados tres meses de la cirugía, a todos los pacientes excepto uno se les realizó una resonancia magnética con contraste para evaluar la resección tumoral. En un caso, el control postoperatorio fue realizado con tomografía computada (Fig. 8). En los siete pacientes que presentaban metástasis, las lesiones fueron resecadas en forma completa. Los cinco casos de meningiomas fueron resueltos con una resección completa de los mismos (Simpson grado I). La paciente con astrocitoma grado II fue intervenida quirúrgicamente en dos oportunidades; luego de la segunda cirugía, la resonancia magnética mostró una resección macroscópicamente completa (Fig. 4). Con respecto a los dos pacientes con diagnóstico anatomopatológico de oligodendroglioma, en los dos casos se realizó una resección macroscópicamente completa (corroborada por resonancia magnética postoperatoria). Sin embargo, la paciente con oligodendroglioma grado III presentó una recidiva tumoral en el margen posterior, a los 9 meses de la primera cirugía. Fue operada nuevamente por la recidiva, con una resección macroscópicamente completa.
De los quince pacientes del presente estudio, siete mostraron déficit motor previo a la cirugía (1 plejía, 1 paresia severa, 1 paresia moderada y 4 paresias leves). En todos los casos hubo una mejoría en el postoperatorio. Los ocho pacientes restantes no presentaron déficit motor antes de la cirugía. Luego del procedimiento quirúrgico, dichos enfermos continuaron sin presentar déficit motor.
DISCUSIÓN
Existe controversia en cuanto a las flexuosidades que presenta el surco central en su recorrido. Los libros de anatomía clásicos como Rouviere5 y Testut6 describen que el surco central presenta tres curvas (rodillas): una superior convexa hacia delante, una media convexa hacia atrás y una inferior convexa hacia delante. Por otro lado, Ono et al7 y Rhoton8 describen al surco central constituido por sólo dos curvas o rodillas: una superior convexa hacia atrás y otra inferior convexa hacia delante. Probablemente la discrepancia se deba a que la curva superior es pequeña y por lo tanto se considera una sola a la rodilla superior y media. Los autores consideran más apropiado pensar en el surco central como compuesto por tres curvas.
Desde el desarrollo del concepto de "Homúnculo", se sabe que la representación cortical de la función motora de la mano se encuentra ubicada en la parte superior del giro precentral9. En 1991, Salamon et al10 describieron la presencia de un típico gancho que correspondía al área de proyección de la mano. En 1995, Naidich y Brightbill11 describieron a la zona de la mano como un área con forma de nudillo. Finalmente, Puce et al12, también en 1995, describieron a la zona motora de la mano con forma de Omega. Por lo tanto, la corteza cerebral encargada de la función motora de la mano se encuentra ubicada en una protrusión precentral con forma de letra Omega invertida, evidente en un plano axial a través del surco central, a nivel de la interdigitación entre los giros pre y postcentral13.
La resonancia magnética es un estudio no invasivo que permite estudiar la topografía de la superficie cortical con un alto grado de resolución espacial3. Yousry et al3 pudieron identificar el surco central en 194 de 198 hemisferios examinados por resonancia magnética (97,9%). La falla para reconocer el surco central fue debido a la presencia de lesiones espacioocupantes en 3 hemisferios y a una porencefalia en el cuarto hemisferio. Yetkin et al1 observaron que en 18 de 22 estudios realizados, el surco central seleccionado por criterios anatómicos (resonancia magnética estándar), coincidió con la selección realizada por resonancia magnética funcional. En dos casos de pacientes con tumores cerebrales, el surco central no pudo ser identificado por la distorsión de la anatomía. En dos casos de voluntarios, el surco central reconocido por resonancia magnética estándar no coincidió con la resonancia magnética funcional. Así, se puede observar que el reconocimiento del surco central, en un hemisferio sin lesión, es cercano al 100%.
Las principales técnicas descriptas para localizar el surco central a través de la anatomía de una resonancia magnética son tres: a) identificar la forma de Omega correspondiente al área motora de la mano3; b) identificar el típico curso del surco frontal superior y el surco precentral14 y c) siguiendo el curso de las ramas anterior horizontal y anterior ascendente de la fisura silviana y del surco precentral15,16. De las tres posibilidades para localizar el surco central, los autores consideran que la utilización del signo de Omega invertida es la técnica más sencilla, fácil de utilizar por cualquier neurocirujano, y ha mostrado un grado de eficiencia, en cerebros sin patología, cercano al 100%3,17. Sin embargo, es a menudo difícil reconocer el surco central, por medio de cualquiera de estas tres técnicas descriptas, cuando existe una lesión espacio-ocupante. Así, surgieron nuevos procedimientos, para evitar depender de una anatomía distorsionada y poco confiable. De esta manera, lo utilizado con mayor frecuencia es: a) resonancia magnética funcional, la cual se basa en cambios en el flujo sanguíneo local y el consumo de oxígeno causado por la activación neuronal4,18-20; b) magnetoencefalografía, la cual es una técnica que registra la actividad funcional cerebral, mediante la captación de campos magnéticos, relacionando las estructuras cerebrales con sus funciones4,21,22; y c) mapeo cortical Intraoperatorio, el cual consiste en realizar, durante la cirugía, potenciales evocados somatosensitivos y estimulación cortical motora23-26.
En nuestro medio es muchas veces difícil contar con estas técnicas sofisticadas de imágenes. Así, los autores creen que utilizando los conocimientos anatómicos en profundidad, se puede de alguna manera suplir la falta de tecnología. Si bien cuando existe una lesión con efecto de masa, cercana o a nivel de la corteza sensitivomotora, donde la anatomía normal se encuentra distorsionada, es sumamente difícil reconocer el surco central, se puede utilizar la anatomía contralateral a la lesión para tener una aproximación de la relación entre la lesión y el surco central. Por lo tanto, los autores sugieren que, utilizando el signo de Omega contralateral al hemisferio enfermo, se puede tener una idea confiable de la relación del proceso tumoral con la corteza sensitivomotora. Los resultados quirúrgicos de la serie de 15 pacientes operados utilizando este método muestran que se pudo preservar la función motora en todos los casos.
CONCLUSIÓN
El signo de Omega, contralateral a la lesión, puede fácilmente y eficientemente ser utilizado para identificar la relación entre la lesión y el surco central ipsilateral.
COMENTARIOS
Es loable la intención de los autores de difundir su experiencia en la localización del área motora de la mano y, por extensión, del resto del hemicuerpo, según dicen, con alto grado de certeza, en forma simple y accesible para todos los neurocirujanos.
La región central o rolándica comprende dos circunvoluciones paralelas que se hallan separadas entre sí por la gran cisura central de Rolando. Son los giros pre y post centrales. Por su gran extensión, así como su particular orientación, esta área involucra tanto la convexidad como la cara mesial de los lóbulos frontal y parietal. Su prolongación sobre la cara interhemisférica está representada por el lóbulo paracentral. Es así que la región en cuestión se encuentra limitada rostralmente por el surco precentral, en la convexidad, y la incisura preoval de Brocca sobre la cara mesial. Caudalmente, sus límites son el surco postcentral en la convexidad y la rama ascendente de la cisura calloso marginal en la cara mesial. Esta cisura limita hacia la región basal el área paracentral. Por fin, hacia las regiones basal y lateral tiene límites en la misma cisura lateral de Silvio. Debido a su particular organización somatotópica así como a sus conexiones, y por ende a las características de los síndromes a ella asociados, actualmente tiende a analizarse esta porción del neocórtex desde el punto de vista clínico-quirúrgico, como una entidad separada del resto de los lóbulos cerebrales.
La predisposición a que en ella asienten lesiones congénitas y/o lentamente evolutivas, asociadas al bajo umbral de exitabilidad cortical característico de esta área, hace que en ella deban efectuarse con frecuencia cirugías de la epilepsia.
Volviendo a la intención de los autores al publicar el presente trabajo, y coincidiendo con ellos, en que es de tal importancia evitar en lo posible una secuela motora que, pese a la coincidencia, discrepamos con ellos, planteando que desde el punto de vista estrictamente funcional, no se puede subestimar o subutilizar la neurofisiología intraoperatoria, a saber, PESS y Estimulación Cortical (EC) en pos de este objetivo, tal cual lo postularon en su trabajo publicado en la Rev Argent de Neuroc 2006; 20: 1-.
Ambas técnicas (PESS y EC), al día de hoy, no deberían considerarse sofisticadas, sino más bien indispensables en un Servicio de Neurocirugía que aborde rutinariamente lesiones quirúrgicas que asienten en o próximas al área central.
De los 15 pacientes que se mencionan, los autores presentan 10. De ellos en sólo 3 (1 meningioma -fig. 5- y 2 metástasis -figs. 8 y 9) se ve con nitidez la relación de proximidad de las lesiones con el área central, siendo por lo tanto, clara la utilidad del signo del omega invertido.
<
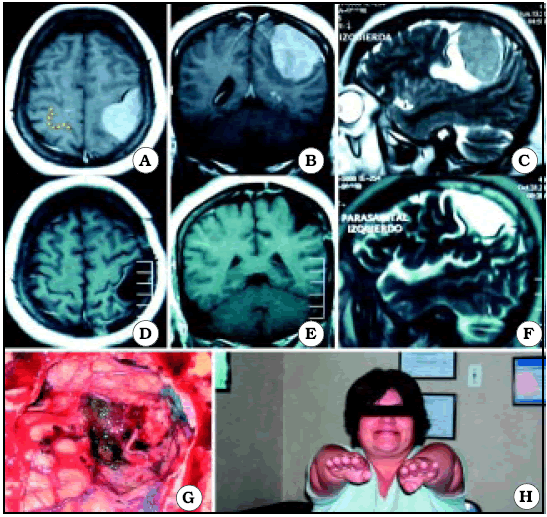
Fig. 5. Caso 4. Paciente mujer de 40 años con diagnóstico por anatomía patológica de Meningioma. A, corte axial de RM mostrando el tumor a nivel del giro precentral y postcentral del lado izquierdo. En el lado contralateral está representada Omega por una línea de puntos de color amarillo. B, corte coronal de RM mostrando el tumor. C, corte sagital de RM mostrando el tumor. D, corte axial de RM luego de la cirugía, mostrando una resección macroscópicamente completa. E, corte coronal de RM luego de la cirugía. F, corte sagital de RM luego de la cirugía. G, foto intraoperatoria luego de resecar el tumor. H, foto de la paciente luego de la cirugía, sin foco motor.
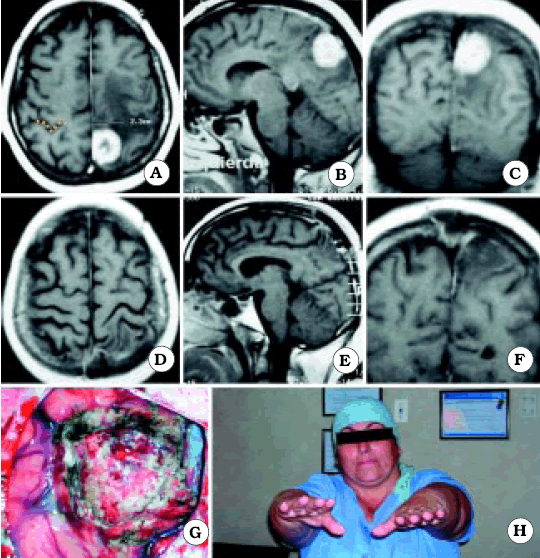
Fig. 6. Caso 7. Paciente mujer de 47 años con diagnóstico por anatomía patológica de Metástasis de Cáncer de Mama. A, corte axial de RM mostrando el tumor a nivel del giro postcentral derecho. En el lado contralateral está representada Omega por una línea de puntos de color amarillo. B, corte sagital de RM mostrando el tumor. C, corte coronal de RM mostrando el tumor. D, corte axial de RM luego de la cirugía, mostrando una resección macroscópicamente completa. E, corte sagital de RM luego de la cirugía. F, corte coronal de RM luego de la cirugía. G, foto intraoperatoria luego de resecar el tumor. H, foto de la paciente luego de la cirugía, sin foco motor.
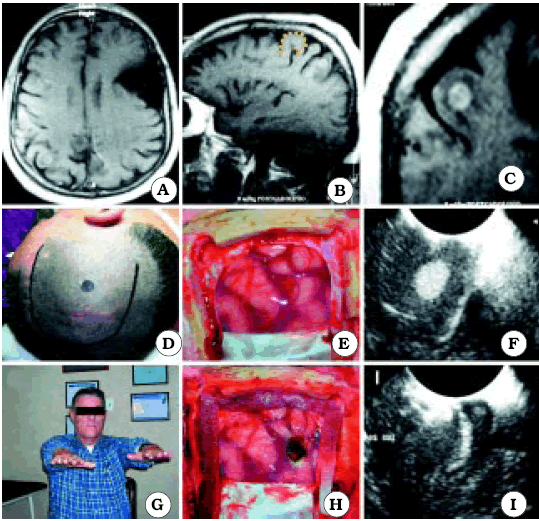
Fig. 7. Caso 9. Paciente varón de 51 años con diagnóstico por anatomía patológica de Metástasis de Cáncer de Pulmón. A, corte axial de RM mostrando el tumor. En el lado contralateral se observa un quiste aracnoideo, no pudiéndose visualizar Omega. Así, a través del corte axial, no se puede relacionar la ubicación de la lesión con el surco central. B, corte sagital de RM mostrando el tumor. En este caso se pudo relacionar el tumor con el surco central a través de un corte sagital, utilizando el signo del gancho hacia atrás, el cual está representado por una línea de puntos de color amarillo. C, corte coronal de RM mostrando el tumor. D, foto operatoria de la incisión en piel. E, foto intraoperatoria antes de resecar el tumor. F, como la lesión era pequeña y subcortical, se utilizó ecografía intraoperatoria para ubicar el tumor. G, foto del paciente luego de la cirugía, sin foco motor. H, foto intraoperatoria luego de resecar el tumor. I, ecografía intraoperatoria luego de la exéresis tumoral.
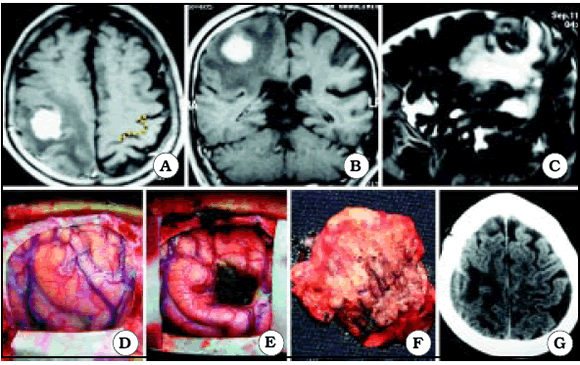
Fig. 8. Caso 14. Paciente varón de 72 años con diagnóstico por anatomía patológica de Metástasis (primario desconocido). A, corte axial de RM mostrando el tumor a nivel del giro precentral derecho. En el lado contralateral está representada Omega por una línea de puntos de color amarillo. B, corte coronal de RM mostrando el tumor. C, corte sagital de RM mostrando el tumor. D, foto intraoperatoria antes de resecar el tumor. E, foto intraoperatoria luego de resecar el tumor. F, foto intraoperatoria mostrando el tumor resecado en una pieza. G, corte axial de TC luego de la cirugía, mostrando una resección macroscópicamente completa.
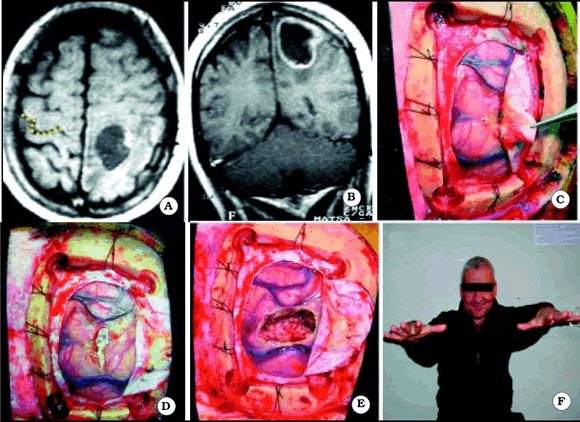
Fig. 9. Caso 11. Paciente varón de 56 años con diagnóstico por anatomía patológica de Metástasis de Cáncer de Laringe. A,, corte axial de RM mostrando el tumor a nivel del giro postcentral izquierdo. En el lado contralateral está representada Omega por una línea de puntos de color amarillo. B, corte coronal de RM mostrando el tumor. C, foto intraoperatoria. Note las adherencias entre el tumor y la duramadre. D, foto intraoperatoria luego de la apertura dural. E, foto intraoperatoria luego de resecar el tumor. F, foto del paciente luego de la cirugía, mostrando una paresia leve derecha.
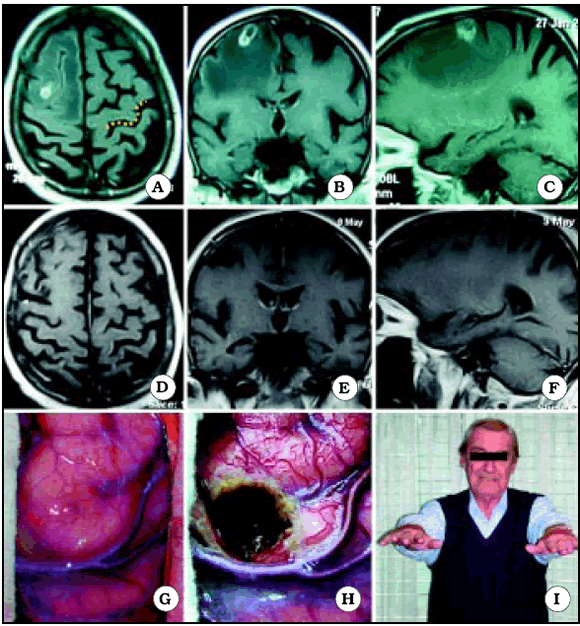
Fig. 10. Caso 15. Paciente varón de 72 años con diagnóstico por anatomía patológica de Metástasis de Cáncer de Pulmón. A, corte axial de RM mostrando el tumor a nivel del giro frontal medio derecho. En el lado contralateral está representada Omega por una línea de puntos de color amarillo. B, corte coronal de RM mostrando el tumor. C, corte sagital de RM mostrando el tumor. D, corte axial de RM luego de la cirugía, mostrando una resección macroscópicamente completa. E, corte coronal de RM luego de la cirugía. F, corte sagital de RM luego de la cirugía. G, foto intraoperatoria antes de resecar el tumor. H, foto intraoperatoria luego de resecar el tumor. I, foto del paciente luego de la cirugía, sin foco motor.
COMENTARIOS
Tal vez, debería ser preocupación de los autores la necesidad de localizar el área motora en patologías benignas, sean tumoral indolente o displásica, que obviamente, se localice en la corteza cerebral del área central. En esos casos, si bien juega a favor del paciente la posibilidad de transferir funciones al hemisferio contralateral (sano), o desplazar la funciones en el ipsilateral, dada la cronicidad de las patologías mencionadas, es indudablemente necesario tener noción exacta de la ubicación del área motora de la mano, como bien dicen los autores, antes de efectuar las resecciones quirúrgicas planificadas, para lo que es de buena práctica contar con estudios funcionales, como la RMf y la neurofisiología intra-op para confirmar o descartar los fenómenos de neuroplasticidad referidos (igual referencia).
En los ejemplos elegidos, lamentablemente, el gran componente edematoso de las metástasis y de los tumores presentados hace de difícil aplicación, desde nuestro punto de vista, el signo del omega invertido del hemisferio contralateral, sobre el enfermo. En los pacientes presentados se observa que fue útil en los 3 casos previamente mencionados.
Respecto a los resultados obtenidos, los mismos son muy halagüeños, aunque no totalmente coincidentes con mi experiencia (Dr. Pomata). He tenido la oportunidad de operar 16 casos (13 niños y 3 adultos) de epilepsias secundarias a lesiones del área central y/ o contiguas a ella, todas benignas (secuelas perinatales, tumores indolentes y malformaciones del desarrollo cortical [MDC]). En general he observado, aún utilizando PESS y estimulación cortical intra-op, un discreto empeoramiento transitorio de los déficits preexistentes y en los casos en que no los había, con alguna frecuencia el paciente los adquirió, recuperándose de los mismos en pocos días o semanas. En uno (mujer de 56 años), de los 3 adultos, padeciente de una displasia cortical del área motora primaria que se resecó completamente, la recuperación ad íntegrum de la hemiparesia post quirúrgica se obtuvo en un lapso de 8 meses.
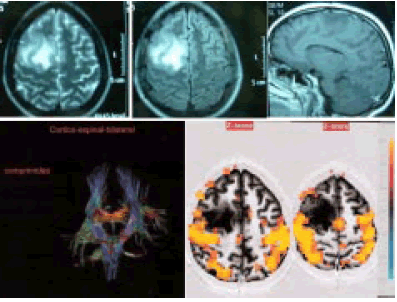
Esta discrepancia podría explicarse en las diferencias anatomopatológicas de ambas series. En la que presento, las patologías asociadas a MDC y/ o tumoral indolente, altamente epileptogénicas, obligaron a su resección no sólo completa, sino también con frecuencia extendida a zonas aledañas, para resecar o transectar (aislar) el área epileptógena primaria responsable de la epilepsia que motivó la cirugía.
Por todo lo antedicho es que es cuestionable el concepto de "confiabilidad, eficiencia, seguridad" que daría la identificación del omega invertido en el hemisferio sano para aplicarlo al enfermo. En las patologías presentadas por los autores, a nuestro entender, el signo del omega invertido tiene un valor orientador que debería ser corroborado por la neurofisiología intra operatoria ya mencionada.
Sin embargo, en patologías menos distorsionantes, el omega invertido podría tener la utilidad que los autores le asignan, teniendo presente, una vez más, que la neuroplasticidad cerebral posibilita la transferencia y / o desplazamiento de la función motora en cuestión. Del anteriormente mencionado trabajo de los mismos autores surge la importancia no sólo de la localización del área motora cortical sino también, y principalmente, de las fibras del tracto corticoespinal, habitualmente desplazado y no lesionado en los pacientes sin o con poco déficit motor pre-op. Es ahí donde cobra importancia la tractografía, único método de diagnóstico en la actualidad para visualizar el estado y la localización exacta, previo a la resección tumoral, del fascículo corticoespinal.
En este punto el signo del omega invertido per sé tiene limitada utilidad.
Hugo B. Pomata, Mariano Cuello, Claudio Vázquez
Se trata de un trabajo prolijo y bien realizado, que cumple requisitos de una presentación, que el lector puede comprender.
Con respecto a los conceptos neurorradiológicos, creo que en estos momentos, contamos con técnicas que pueden ubicar áreas corticales elocuentes con mayor seguridad, como por ejemplo la resonancia funcional, junto con la tractografía, en este caso en particular del área motora primaria.
Los procesos expansivos, primarios o secundarios, provocan desplazamientos de los mismos, no sólo por el edema. En primarios de larga evolución, hay reorganización y reubicación de dichas áreas elocuentes, que los métodos convencionales, intraaxiales y extracraneanos, no son suficientes para localizarlas.
Manuel Martínez
Neurorradiólogo
Bibliografía
1. Yetkin FZ, Papke RA, Mark LP, Daniels DL, Mueller WM, Haughton VM: Location of the sensorimotor cortex: functional and conventional MR compared. AJNR 16:2109-2113, 1995.
2. Kumabe T, Nakasato N, Inoue T, Yoshimoto T: Primary thumb sensory cortex located at the lateral shoulder of the inverted omegashape on the axial images of the central sulcus. Neurol Med Chir (Tokyo) 40:393-403, 2000.
3. Yousry TA, Schmid UD, Alkadhi H, Schmidt D, Peraud A, Buettner A, Winkler P: Localization of the motor hand area to a knob on the precentral gyrus. A new landmark. Brain 120:141-157, 1997.
4. Korvenoja A, Kirveskari E, Aronen HJ, Avikainen S, Brander A, Huttunen J, Ilmoniemi RJ, Jaaskelainen JE, Kovala T, Makela JP, Salli E, Seppa M: Sensorimotor cortex localization: comparison of magnetoencephalography, functional MR imaging, and intraoperative cortical mapping. Radiology 241:213-222, 2006.
5. Rouviere H, Delmas A: Anatomía Humana. Descriptiva, Topográfica y Funcional. 9º Edición. Masson, Barcelona. Tomo 3, p 669, 1994.
6. Testut L, Latarjet A: Tratado de Anatomía Humana. 9º Edición. Salvat Editores, Barcelona. Tomo 2, p 951, 1958.
7. Ono M, Kubik S, Abernathey CD: Atlas of the Cerebral Sulci. Stuttgart, Georg Thieme Verlag, 1990.
8. Rhoton AL Jr: The cerebrum. Neurosurgery 51(Suppl 1):1-51, 2002.
9. Penfield W, Boldrey E: Somatic motor and sensory representation in the cerebral cortex of man as studied by electrical stimulation. Brain 60:389-443, 1937.
10. Salamon G, Martini P, Ternier F, Vibert E, Murayama N, Khadr E: Topographical study of supratentorial brain tumors. J Neuroradiol 18:123-140, 1991.
11. Naidich TP, Brightbill TC: The intraparietal sulcus: a landmark for localization of pathology on axial CT scans. Int J Neuroradiol 1:3- 16, 1995.
12. Puce A, Constable RT, Luby ML, McCarthy G, Nobre AC, Spencer DD, Gore JC, Allison T: Functional magnetic resonance imaging of sensory and motor cortex: comparison with electrophysiological localization. J Neurosurg 83:262-270, 1995.
13. Alkadhi H, Kollias SS: Pli de passage fronto-pariétal moyen of Broca separates the moto homunculus. AJNR Am J Neuroradiol 25:809- 812, 2004.
14. Kido DK, LeMay M, Levinson AW, Benson WE: Computed tomographic localization of the precentral gyrus. Radiology 135:373-377, 1980.
15. Ebeling U, Steinmetz H, Huang YX, Kahn T: Topography and identification of the inferior precentral sulcus in MR imaginag. AJR Am J Roentgenol 153:1051-1056, 1989.
16. Naidich TP, Valavanis AG, Kubik S: Anatomic relationships along the low-middle convexity: Part I - normal specimens and magnetic resonance imaging. Neurosurgery 36:517-532, 1995.
17. Caulo M, Bastos A: Localization of the central area of the brain: How can it be done? http://mni.mcgill.ca/neuroimage/pdf_files/oct2000.pdf, pp 4 y 5, 2000.
18. Krings T, Reul J, Spetzger U, Klusmann A, Roessler F, Gilsbach JM, Thron A: Functional magnetic resonance mapping of sensory motor cortex for image-guided neurosurgical intervention. Acta Neurochir (Wien) 140:215-222, 1998.
19. Inoue T, Shimizu H, Nakasato N, Kumabe T, Yoshimoto T: Accuracy and limitation of functional magnetic resonance imaging for identification of the central sulcus: comparison with magnetoencephalography in patients with brain tumors. Neuroimage 10:738-748, 1999.
20. Majos A, Tybor K, Stefanczyk L, Góraj B: Cortical mapping by functional magnetic resonance imaging in patients with brain tumors. Eur Radiol 15:1148-1158, 2005.
21. Sobel DF, Gallen CC, Schwartz BJ, Waltz TA, Aung M, Copeland B, Yamada S, Hirschkoff EC, Bloom FE: Locating the central sulcus: comparison of MR anatomic and magnetoencephalographic functional methods. AJNR Am J Neuroradiol 14:915-925, 1993.
22. Hund M, Rezai AR, Kronberg E, Capell J, Zonenshayn M, Ribary U, Kelly PJ, Llinas R: Magnetoencephalographic mapping: basic of a new functional risk profile in the selection of patients with cortical brain lesions. Neurosurgery 40:936-942, 1997.
23. Berger MS, Ojemann GA y Lettich E: Neurophysiological monitoring during astrocytoma surgery. Neurosur Clin N Am 1:65-80, 1990
24. Matz PG, Cobbs C y Berger MS: Intraoperative cortical mapping as a guide to the surgical resection of gliomas. J Neuro Oncol 42:233- 45, 1999.
25. Helmers SL: Evoked potentials for cortical mapping in children and adults. Tech Neurosurg 7:4-11, 2001.
26. Tróccoli G, Echevarría G, Torresi S, Villar D, D'Annuncio E, Campero A, Zemma E, Salman G: Resección de lesiones cerebrales en área rolándica con mapeo cortical intraoperatorio. Rev Argent Neuroc 20:1-6, 2006.

