Título
Autor
Fecha
Lugar de Realización
Cátedra de Neurología y Neurocirugía, Facultad de Medicina, UNNO
Texto
Actualización
Fisiopatología del Edema Cerebral
Walter Nigri , Daniel Godoy y Rodolfo Recalde
Neurocare .Servicio Neurológico Privado.
Cátedra de Neurología y Neurocirugía, Facultad de Medicina, UNNO
Correspondencia: San Martin 2473 (3400) Corrientes, email: nigri@sat link.com
RESUMEN
Se define como edema cerebral a la acumulación anormal de agua y solutos en el parénquima encefálico. Este volumen patológico puede actuar como una lesión ocupante de espacio , determinando desplazamientos cerebrales e isquemia . Las formas más comunes de edema cerebral son el vasogénico y el citotóxico, pero ademas existen otras formas de edema, tales como , el hidrocefálico, osmótico, tumoral e intersticial. En el edema vasogénico hay rotura de la barrera hematoencefalica (BHE) lo que causa la extravasación de proteínas y sustancias osmóticamente activas que conducen a la acumulación de agua en el compartimiento intersticial. En laforma citotóxica en cambio la BHE está intacta, siendo el astrocito la célula que se hincha como respuesta a una amplia variedad de injurias (hipoxia, isquemia, trauma, etc.). Se localiza preferentemente en la sustancia gris y su génesis responde a variados mecanismos (alteración de canales voltage dependiente Na+ / HCO3-; H+ / CI-; elevación extracelular de potasio, liberación de aminoacidos exitatorios, generación de radicales libres, etc,). Este tipo de edema compromete el metabolismo celular hasta su muerte principalmente a través de disrupción de la membrana celular, creando un círculo vicioso que induce a más edema y muerte . En esta revisión analizaremos la fisiopatología y evolución de las distintas formas de edema.
Palabras clave: edema cerebral, edema citotóxico, edema vasogénico, hinchazón cerebral.
ABSTRACT
Cerebral oedema is defined as the abnormal accumulation of water and solutes in brain tissue.
This pathological volumen accumulation may act as a space occuping mass that could determinate shifts of cerebral tissue and ischaemia. The vasogenic and cytotoxic oedema are the most common varietyes of edema, but there are also otherforms of tissue water accumulation as the hydrocephalic, osmotic, tumoral and intersticial oedema. In the vasogenic oedema there is a breakdown of the blood brain barrier (BBB) that causes the extravasation of proteins and osmotic active substances that leads to water accumulation into intersticial compartiment.
Meanwhile in the cytotoxic form the BBB is intact, being the astrocyte is the cell who swells secondary to a vide variety of insults (hipoxia, ischaemia, trauma, etc,). It is localized preferently in the gray matter and there are many mechanisms involved in his genesis (alteration of voltage- depending channels Na+ / HCO3- and Cl- / H+, extracellular K+ raise, release of excitatory amino acids, hipo-osmolality, free radicals). This kind of oedema produce impairment of cellular metabolism leading to cellular death due to plasmatic membrane disruption. This metabolic alteration creates a viciouse circle that induces more oedema and more tissular damage. The evolution and the natural resolution of thisforms of oedema are treated in this review, the same as the others kinds of cerebal oedema.
Key words: Cerebral oedema, cytotoxic oedema, vasogenic oedema, brain
INTRODUCCIÓN
Edema deriva de la palabra griega oiedema que significa hinchazón1. Se lo define como la acumulación anormal de agua en el parénquima cerebral como resultado de una patología general o local.
Como volumen patológico que es, el edema ejerce un efecto de masa, el que repercute sobre el cerebro por dos mecanismos: a) provocándole deformaciones y desplazamientos (hernias), y b) gravitando sobre su vasculatura, determinando isquemias por compromiso de su flujo sanguíneo cerebral (FSC).
Consiste en una ganancia anormal de agua y solutos, con el consiguiente aumento del volumen cerebral, que puede tornarse crítico en el momento en que se agotan los mecanismos compensatorios intracraneanos, según se expresa en los enunciados de Monro - Kelly.
Klatzo2 distinguió dos formas de edema: el vasogénico y el citotóxico basándose en sus diferentes mecanismos de producción. En el edema vasogénico, hay lesión de las paredes de los vasos (barrera hematoencefálica), lo que aumenta la permeabilidad para el agua y demás componentes plasmáticos hacia el espacio extracelular.
Por otro lado, el edema citotóxico, en el cual, un factor nocivo afecta directamente la célula, caracterizándose por el mantenimiento de la pared vascular intacta, limitando de esa manera la hinchazón al cuerpo celular.
Edema vasogénico
Es la modalidad de edema de más frecuente observación en la práctica clínica diaria,
Se produce debido a un incremento de la entrada de agua y solutos al espacio extravascular por alteración de la barrera hematoencefálica (BHE), la que pierde su selectividad para retener ciertos componentes plasmáticos.
Dicha alteración puede ser localizada (infartos, tumores, abscesos, contusiones, etc,) o generalizada, casos en los que se ve afectada gran parte o toda la microcirculación cerebral.
El fluido que se acumula en el espacio extra-vascular es un filtrado del plasma, por lo tanto, rico en proteínas.
La existencia de barrera hematoencefálica implica que en el cerebro tiene plena vigencia la Ley de intercambio de fluidos de Starling, así como en el resto de los capilares del organismo. Existen fuerzas que tienden a que el liquido intravascular abandone su lugar, como ser la presión hidrostá tica del capilar y la presión coloidosmótica ejercida por las proteínas intersticiales, a esto se oponen, tanto la presión coloidosmótica generada por las proteínas plasmáticas , como así también la presión hidrostática del intersticio , no debiéndonos olvidarnos de analizar una de las propiedades, sino la más importante de las membranas su permeabilidad.
LEY DE STARLING

Donde:
Q = flujo a través del capilar
Kf = coeficiente de filtración (flujo x unidad de tiempo x unidad de presión x 100 gr de tejido) Phc = presión hidrostática capilar
Phi = presión hidrostática del intersticio
8 = coeficiente de reflexión proteica (expresa la permeabilidad de las membranas para las proteínas, como así también, su relación con el pasaje de agua )
TCC = presión coloidosmótica plasmática ni = presión coloidosmótica del intersticio
Si existe una alteración de la BHE, se pierde el control, y un filtrado del plasma que incluye proteínas, es "empujado" por la presión hidrostática (dependiente de la presión arterial), hacia el intersticio a través de las uniones endoteliales que han perdido su especificidad, mientras que las células sanguíneas son retenidas en el espacio intravascular gracias a la impermeabilidad residual de la barrera, salvo en los casos en que la lesión del vaso sea lo suficientemente severa como para permitir una extravasación (hemorragia).
Se han reconocido tres fases evolutivas5 (Fig. 1) del edema vasogénico, consistentes en:
1) Fase exudativa: hay escape de proteínas plasmáticas, agua y electrolitos hacia el espacio intersticial que determinan una expansión del mismo. El fluido edematoso incrementa así la presión coloidosmótica en este neoespacio como consecuencia de la concentración de proteínas plasmáticas.
2) Fase de propagación: el exudado se desplaza entre las fibras nerviosas de la sustancia blanca siguiendo su trayecto en forma de digitaciones, separando a las mismas entre sí. En la sustancia gris, en cambio, el tramado tisular de la misma impide ese modelo de migración del exudado, Se genera así una suerte de "atrapamiento", donde el líquido se acumula sin una dirección de flujo clara, a menos que lo haga hacia los ventrículos.

Fig. 1. Fases Evolutivas del Edema Vasogénico, Modif, de Go K G5.
El edema, por otra parte, no se distribuye de manera uniforme en todas la extensión de la sustancia blanca. En ciertas estructuras más compactas como la cápsula interna, las radiaciones ópticas, el cuerpo calloso y la sustancia blanca del tronco cerebral el exudado penetra con más dificultad, y en consecuencia más lentamente.
La migración de este exudado es dependiente de la presión de perfusión. En la sustancia gris no se observa este patrón, debido a la mencionada cohesión interneuronal que allí existe. La magnitud del edema está entonces relacionada con la presión arterial, interaccionando aquí la autorregulación cerebral como mecanismo atenuador, capaz de reducir la propagación de la presión arterial hacia el lecho capilar.
3) La fase de resolución: implica la eliminación del exudado a través de variados mecanismos, como ser: reabsorción hacia los capilares, drenaje hacia el LCR, acción de células de la glia, o el escape hacia los nódulos linfáticos cervicales.
Otros mecanismos de producción de edema vasogénico, son los que se deben a la alteración en el sistema de transporte endotelial por causa metabólica (fundamentalmente isquemia) o los que aparecen en el edema peritumoral, (especialmente alrededor de gliomas y metástasis), donde los vasos de neoformación carecen de uniones estrechas en su endotelio6.
Young y Constantini1 han propuesto una forma de edema que llamaron "edema iónico". En realidad, este tipo de edema corresponde a una variedad vasogénica , en la cual hay una ganancia de fluidos por el parte del cerebro, proveniente del compartimento vascular, pero como consecuencia de una hiperactivación o un "exceso de trabajo", por parte de transportadores iónicos.
como ser: Na+- K+, ATPas ; Na+- H+ y Cl-HCO3-, no se altera la BHE.
Esta activación exacerbada se debería a cambios del estado ácido-base.
De todas maneras, existen muy pocas evidencias publicadas en la literatura, que avalen en forma concluyente, la relación entre estos transportadores y el aumento del volumen cerebral.
Edema celular o citotóxico
Se le dio el nombre de citotóxico debido a que originalmente Klatzo lo observó como respuesta frente a la intoxicación experimental con neurotoxinas en animales de laboratorio.
Se manifiesta como acumulación anormal de líquido intracelular , sin alteración de la permeabilidad de la BHE, correspondiéndole al astrocito el privilegio de ser el primer actor.
Su papel protagónico principal es actuar más que como una lesión ocupante, como un factor deletéreo vinculado a la producción de compuestos tóxicos que afectan el metabolismo tisular.
Se lo observa preferentemente acompañando a insultos isquémicos, traumáticos y/ o hipóxicos y se aloja predominantemente en la sustancia gris.
Estudios realizados desde 1967 han indicado que el término edema citotóxico era muy restrictivo, y que el término hinchazón celular sería el preferible8, Los exámenes microscópicos de esa época revelaron una hinchazón en la sustancia blanca sin aumento de la permeabilidad de la BHE. Klatzo concluyó en consecuencia que la hinchazón era primariamente intracelular.
En otras palabras, la hinchazón astrocitaria, se asocia a efectos metabólicos nocivos que, independientemente de la expansión volumétrica que generan, actúan como factores agravantes. Gene ralmente coexiste con el edema vasogénico.
Se debe diferenciar de la astrogliosis reactiva, que si bien determina también un aumento del tamaño astrocítico, consiste en una hipertrofia de éstas células debido a una síntesis aumentada de filamentos gliales y otros constituyentes intracelulares que inducen incremento del tamaño celular, y que suele observarse como una respuesta tardía a la injuria9.
Es ahora más claramente reconocido que es el astrocito quien evidencia hinchazón después de isquemia y trauma, mientras que la neurona y el oligodendrocito están casi siempre respetados.
Debido al mejor conocimiento de las funciones del astrocito, uno puede imaginarse que la hinchazón astrocítica puede ser un evento temprano importante, que predispone al cerebro a un mayor daño debido a la falla funcional del astrocito como regulador homeostático10,11
En principio, la hinchazón celular puede ocurrir sin una ganancia neta de agua por el cerebro, simplemente por medio de intercambio de solutos y agua desde el espacio extracelular, el cual disminuye a un espacio intracelular que aumenta.
Los mecanismos implicados en la génesis de la hinchazón astrocítica son complejos y variados1 (Fig, 3)
1) La operación simultánea de los intercambiadores C1-/HCO3 y Na+/H+ con H+ y HCO3-, generan acumulación de ClNa en el interior celular, para de esa manera, crear gradientes osmóticos que facilitan la acumulación de líquidos en el interior del astrocito.

Fig. 2: Modif, de Kimelberg K. Harold J.1
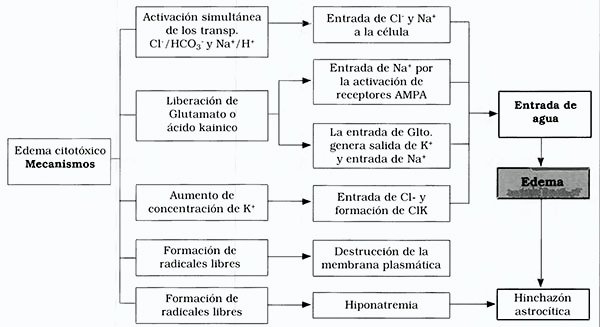
Fig. 3. Mecanismos de producción del edema citotóxico
2) El glutamato o su análogo el ácido kaínico, producen edema, estimulando en las neuronas una producción exagerada de metabolitos dependientes del CO2 e H+. También el astrocito adquiere glutamato por medio de un mecanismo de transporte dependiente del Na+, así la entrada de glutamato en el interior celular se acompaña de una salida de K+ y de sus equivalentes alcalinos,
Sin embargo Sontheimer12 et al propusieron la existencia de un receptor AMPA específico que produce entrada de Na+. Los iones acompañantes serían el Cl- y el HCO3-, los que pueden ingresar a la célula por canales aniónicos que se abrirían frente a las mencionadas injurias agudas. Normalmente la permeabilidad del astrocito para el Na+ es baja; de manera que este ion ingresa gracias a la activación de transportadores específicos como los Na+ /H+ o la apertura de canales de Na habitualmente cerrados.
3) La concentración alta de K+ (>20 mM) extracelular, observadas luego de stroke o trauma, derivan en hinchazón celular por salida masiva de ClK, debido a las fuerzas Donnan (ley de electronegatividad de las soluciones). Este mecanismo es dependiente de un gradiente electromecánico común a todas las células, Esta salida de K+, se realiza por canales de K+ dependientes de voltaje, mientras que el Cl- ingresa por canales aniónicos, Los canales de Cl- en el astrocito normalmente se encuentran cerrados en la fase de potencial de membrana en reposo, pero se activan con la hinchazón facilitando aún más la entrada del anión, al interior celular.
4) La hinchazón del astrocito también se puede producir por alteración en la permeabilidad selectiva de su membrana a los elementos plasmáticos como consecuencia de la liberación de radicales libres, por ejemplo el anión superóxido (O2-)13, Estos radicales libres llevan a peroxidación lipídica y degradación de la cadena insaturada de ácidos grasos que termina con la total destrucción de la membrana plasmática. La alteración de la BHE podría también ser desencadenada por la producción de radicales libres en los vasos sanguíneos1.
5) La hipoosmolaridad, es una condición generalmente inducida por bajas concentraciones plasmáticas de Na+ (edema cerebral de los estados hipoosmolares). Está demostrado experimentalmente que la administración de agua libre determina la aparición de hiponatremia que genera hinchazón astrocítica (no así neuronal u oligodendrocítica), El análisis bajo microscopio electrónico de las neuronas contiguas a estos astrocitos evidenció un patrón lesional similar al observado en la isquemia.
¿ Por qué le sucede esto a los astrocitos y no a las neuronas o a los oligodendrocitos?, en principio, esto sucede debido a que los osmolitos liberados por éstas células son captadas selectivamente por los astrocitos (acción protectora) perpetuándose así el fenómeno edematógeno.
La resolución de esta variedad de edema se realiza por medio de los macrófagos y de las células de la microglía, Estas células actúan "barriendo" del tejido edematoso los desechos celulares y proteínas, Los astrocitos no juegan un papel importante en la resolución de este tipo de edema, contrariamente a lo que ocurre en la forma vasogénica14.
EDEMA OSMÓTICO
Es el resultado del influjo de agua hacia el parénquima cerebral en presencia de un gradiente osmótico creado entre el plasma y el espacio extracelular, ya sea por disminución de la osmolaridad plasmática o por un incremento de la osmolaridad tisular, El agua entra al espacio intersticial, tanto de la sustancia blanca como de la sustancia gris. Hay una hinchazón de todos los elementos celulares (células gliales, neuronas y células endoteliales) y además un aumento del volumen ventricular', Estos gradientes osmóticos se pueden generar frente a intoxicación acuosa, la infusión incorrecta de fluidos, retención de agua debido a un síndrome de secreción inadecuada de ADH, natridiuresis excesiva, durante hemodiálisis, cuando los niveles de urea plasmáticos descienden rápidamente.
La BHE aquí se encuentra intacta y es necesaria esta condición para la génesis de esta modalidad de edema. El líquido acumulado es fundamentalmente agua libre.
Contrariamente a lo que sucede frente a la hipoosmolaridad plasmática aguda con hiponatremia asociada, ésta es capaz de producir edema cerebral, mientras que la hiponatremia crónica no se asocia con un aumento del contenido de agua cerebral.
EDEMA HIDROSTÁTICO
Esta variedad de edema es en realidad un trasudado o ultrafiltrado de líquido de localización extracelular con bajo contenido de proteínas,
Se origina como consecuencia de un gradiente hidrostático, o sea una sobrecarga hidrostática del lecho capilar, favorecido por alteración en la autorregulación15 que fuerza el paso de agua desde el espacio intravascular al extracelular. Se ha visto en el traumatismo craneoencefálico (TEC) experimental, hipertensión (asociada a vasodilatación hipercápnica), vasoparálisis, fenómenos de reperfusión herhisférica posterior a la evacuación de determinados hematomas5. La BHE permanece inalterada, En la práctica médica es muy difícil de diferenciar del edema vasogénico15.
EDEMA INTERSTICIAL (HIDROCEFÁLICO)
El ejemplo clásico es el del edema periventricular de la hidrocefalia, el que se produce por aumento de la presión intracavitaria, la que "fuerza" el líquido hacia el intersticio adyacente. Se manifiesta en la tomograía axial computada (TAC) como una hipodensidad "esfumada" periventricular, especialmente a nivel de las porciones polares de los ventrículos laterales.
EDEMA COMPRESIVO
Descripto por Milhorat6, se define como un aumento del fluido intersticial consecutivo a la obstrucción al flujo de fluido intersticial y/o compromiso del drenaje venoso. El ejemplo más típico es el que se ve en los meningiomas y otros tumores benignos extra-axiales como los Schwannomas, craneofaringiomas, etc., donde la compresión cerebral interfiere con el libre flujo del fluido intersticial,
EFECTOS DELETÉREOS DEL EDEMA CEREBRAL
La presión de perfusión cerebral se expresa:
PPC = PAM - PIC
La letalidad del proceso edematoso se debe fundamentalmente al síndrome de hipertensión endocraneana, el cual genera fenómenos tales como desplazamientos, hernias e isquemia cerebral .
Teniendo en cuenta que los principales determinantes de la PPC son la PAM y la PIC, todo incremento de esta última habrá de influir en forma directa sobre el FSC.
Existen además otros mecanismos más sutiles que pueden generar lesiones, por ejemplo la separación progresiva de los vasos capilares que se observa en el edema vasogénico, Esto genera dificultades en el correcto aporte de O2 y sustratos necesarios para mantener el metabolismo tisular de esas áreas. El O2 pasa del capilar a la célula por un proceso de difusión, y en todo procesó difusivo el tiempo requerido por una sustancia para recorrer un determinado espacio es proporcional al cuadrado de la distancia". Si el espacio entre el capilar y la célula aumenta al doble, el O2 tardará para recorrer esta distancia, 4 veces más, generándose así , un fenomeno neuroisquémico que a su vez genera más edema, creándose un círculo vicioso.
Tabla 1. Resumen comparativo de las diferentes modalidades de edema

Se entiende así por qué el FSC se encuentra disminuido en las zonas vecinas al edema15.
Sustancias como el glutamato, serotonina, ac. grasos y componentes del sistema kalicreína-kinina generados secundariamente a la lesión tisular cortical por el edema, son capaces de atravesar la BHE dañada, generando cascadas metabólicas con potencial lesivo para la membrana celular , perpetuando los mecanismos productores de edema16.
El ácido araquidónico (AA) y sus metabolitos (prostaglandinas y leucotrienos) de las sustancias que se liberan en los procesos isquémicos, son los de mayor poder lesivo17. El ácido araquidónico aumenta su concentración tisular después de ciertos insultos cerebrales, habiéndose demostrado su papel en la génesis del edema citotóxico, activa las fosfolipasas responsables de la destrucción de la membrana celular. La administración experimental de AA en cultivos celulares gliales genera un aumento dosis-dependiente del volumen de las células de hasta un 119% respecto a los valores basales17. El mecanismo más probable sería una activación de la peroxidación lipídica de la membrana celular con el consiguiente aumento de la permeabilidad al Na+ y el arrastre progresivo de agua hacia la célula18.
CONCLUSIONES
En síntesis; el edema cerebral es un fenómeno inespecífico de respuesta tisular a una amplia variedad de injurias.
Aún en sus modalidades más comunes, raramente se presenta bajo una forma individual o aislada; ellas suelen coexistir, o sucederse una a la otra ("maduración del edema").
Todas las formas de edema, no sólo coexisten, sino que interactúan en forma constante y dinámica (Rosner19), así, el edema vasogénico genera elevaciones de la presión intracraneana, disminuyendo la perfusión tisular, generando hipoxia, la cual actúa como el disparador de los mecanismos de producción del edema citotóxico. Por otro lado, los eventos capaces de producir citotoxicidad no se limitan a las membranas celulares, sino que afectan también las membranas vasculares y el endotelio, aumentando su permeabilidad generando así edema vasogénico.
En cualquiera de sus formas, el edema, siempre determina, en mayor o menor grado una cuota de muerte celular.
Encierra en su génesis la potencial capacidad de perpetuarse y/ o autoagravarse.
La coexistencia con otras formas de hinchazón cerebral que suelen obedecer a las mismas noxas, tales como la tumefacción cerebral o "brain swelling", (debida a la dilatación del lecho vascular y aumento del contenido de sangre intracraneana), se potencian con las verdaderas formas de edema y agravan aún más las condiciones intracraneanas, especialmente cuando los mecanismos reguladores de la PIC se encuentran en vías de agotamiento (compliance estrechada).
Por ello, el edema debe ser considerado, más que la simple presencia de agua en el parénquima, como un amenazante volumen patológico intracraneano responsable de evoluciones devastadoras.
Comprender su significado es comprender la necesidad de tratarlo a tiempo.
Bibliografía
1. Kimelberg K Harold J "Currents concepts of brain edema. Review of laboratory investigations", J Neurosurgery 83: 1051-1059, 1985.
2. Dagi T, George E, Surgical management of penetrating missile injuries of the head. En: Schmidek H H. Schmidek W H, ed ,Operative neurosurgical techniques. 3rd edition, Philadelphia: Saunders. 1995, vol 1, pp 83.
3. Cserr H F, Patlak C S Regulations of brain volume under isosmotic and anisosmotic conditions. Adv. Comp. Environ. Physiol 9: 61-80, 1991.
4. Rapaport S I Roles of cerebrovascular permeability, brain complíance, and brain hydraulic conductivity invasogenic brain edema, in Popp A J, Bourke R S, Nelson L R, et al. (eds,): Neural Trauma, NewYork: Rayen Press, 1979, pp 51-62.
5. Go K G The normal and pathological physiology of brain water, En: Cohadon F Ed, Advances and technical standars in neurosurgery. Wien/ New York: Springer Verlag, 1997, vol: 23, pp 47-142.
6. Gumerlock M K, Blood brain barrier and cerebral edema. En: Tindall G T, Cooper P R. Barrow D L ed: The practice of neurosurgery. Baltimore: Wiliams and Wilkins, 1996, vol 1, pp 3-12,
7. Young W, Constantini S: lonic and water shifts in injuried central nervous tissue, in Salzman SK, Faden Al (eds.): The Neurobiology of Central Nervous System Trauma, New York: Oxford University Press, 1994, pp 123-130.
8. Klatzo Y: Presídential Address: Neuropathological aspects of brain edema. J Neurosurgery Exp. Neurol 26: 1-13, 1967.
9. Kimelberg H K, Norenberg M D Astrocytic responses to centrál nervous system trauma, in Salzman S K, Faden A I (eds.): The Neurobiology of Central Nervous System Trauma. New York: Oxford University Press, 1994, pp 193-208.
10. Kimelberg H K Astrocvtic edema in CNS trauma. J Neurotrauma 9 (Suppl 1): S71-S81, 1992.
11. Kimelberg Irl K, Ransom BR Physiological and pathological aspects of astrocytic swelling, in Fedoroff S, Vernadakis A. (eds.): Astrocytes. Orlando, Florida: Academic Press, 1986. pp 129-166.
12. Sontheimer H., Kettenmann H.. Backus K.H. et al.: Glutamate opens Na+ /K+ channels in cultured astrocytes. Olio. 1: 328-336, 1988.
13. Halliwell B, butterídge J M C Oxigen radicals and the nervous system, Trends Neurocience 8: 2226, 1985
14. Klatzo Y Pathophysiological aspects of brain edema. Acta Neuropathol 72: 236-239, 1987,
15. Sahuquilo J, Rodríguez-Baeza A, Pedraza S, Munar F, Poca' M A, Rubio E, Alteraciones de la microcirculación y de la barrera hematoencefálica en los traumatismos craneoencefálicos. Fisiopatología del edema cerebral postraumático. En: Net A, Marruecos-Sant L. De Traumatismo carneoencefálico grave. Barcelona. Springer Verlag Ibérica, 1996, vol 1, pp 19-44.
16. Pollay M Blood-brain barrier; Cerebral edema. En: Wilkins R. H,, Rengachary SS, Neurosurgery, Mc Graw-Hill Company. New York 1985, pp 322-331.
17. Staub F, Winkler A, Peters J, Kempski O, Baethmann A Mechanisms of glial swelling by Arachidonic Acid. Acta Neurochir. (Suppl) 60: 20-23, 1994.
18. Long D M Traumatic Brain Edema. Clin Neurosurgery 29 :174-202, 1982.
19. Rosner M: Pathophysiology and management of increased intracranial pressure, En: Andrews BT (ed) Neurosurgical Intensive Care. McGraw-Hill. San Francisco, 1983, pp 57-112.
