Título
Autor
Fecha
Lugar de Realización
Correspondencia
Texto
Rev. argent. neurocir. v.22 n.1 Ciudad Autónoma de Buenos Aires mar. 2008
Utilización de la vía transcoroidal para craneofaringioma recidivado
Pablo Seoane1, Gonzalo Bonilla1,2, Sergio Pallini1, Vilma Passante1, Daniel Desole1, Mario Amaolo1
1Servicio de Neurocirugía, H. Gral. 601 - Hospital Militar Central,
2Tercera Cátedra de Anatomía, Prof. Dr. Homero Bianchi, Laboratorio 6 Neuroanatomía, Facultad de Medicina, UBA, Buenos Aires, Argentina
Correspondencia: dotorpablo@hotmail.com
Recibido: julio de 2007; aceptado: febrero de 2008.
RESUMEN
Objetivo. Describir la anatomía quirúrgica del abordaje transcoroidal al tercer ventrículo por vía transcallosa anterior. Describir y comparar los otros corredores posibles, y presentar dos casos de craneofaringioma recidivado tratados por esta vía de abordaje.
Material y método. Se estudiaron las estructuras involucradas en tres especímenes cadavéricos fijados e inyectados para este menester. Se revisaron las Historias Clínicas, estudios, partes quirúrgicos y fotos intraoperatorias de dos casos de craneofaringioma recidivado tratados en nuestro Servicio. Ambos eran gigantes y comprometían el tercer ventrículo en su parte anterior. Para su análisis se tuvo en cuenta las clasificaciones de craneofaringiomas de Samii y de Yasargil.
Resultados. La tela coroidea se adhiere al trígono por la tenia fórnices, y al tálamo por la tenia thalami. Consta de una membrana superior, que yace debajo del trígono, un espacio vascular, por donde circulan las venas cerebrales internas y las arterias coroideas posteromediales, y una membrana inferior, que forma el techo del tercer ventrículo y porta el plexo coroideo del mismo. El abordaje transcoroideo ingresa por la tenia fórnices, reclina el trígono y atraviesa la tela coroidea sin sacrificar estructuras vasculares. En ambos pacientes se pudo reducir la masa tumoral parcialmente, vaciando los quistes existentes y colocando un catéter con reservorio en el componente quístico. Ambos pacientes evolucionaron favorablemente. En un caso no se observó recidiva después de 11 meses. En el otro, se realizan punciones cada 4-5 meses para vaciamiento del quiste, por cefalea y disminución de la agudeza visual (follow up 20 meses).
Conclusión. La vía transcoroidal no es un abordaje de elección para el tratamiento de los craneofaringiomas. Sin embargo, en los casos recidivantes, las adherencias y fibrosis postoperatorias de la loge quirúrgica, pueden impedir la identificación de estructuras vasculares, nerviosas y funcionales; un abordaje "virgen" que permita una correcta identificación de estas estructuras es deseable. La vía transcoroidal aparece como una alternativa válida para algunos casos de craneofaringioma recidivado.
Palabras clave: Abordaje transcalloso; Anatomía del III ventrículo; Craneofaringioma; Vía transcoroidal.
SUMMARY
Objective. To describe the surgical anatomy of transcallosal transchoroidal approach to the third ventricle. The other corridors are also analyzed and compared. To present two cases of relapsing craniopharyngiomas treated through this approach.
Material and methods. Three fixed and injected brains were prepared to study the involved structures. The clinical reports of two patients with relapsing craniopharyngiomas treated in our Service were analyzed. Both were giant and involved the anterior third ventricle and were classified after the scales of Samii and Yasargil.
Results. The velum interpositum adheres to the fornix by the tenia fornices and to the thalamus by the tenia thalami. It consists of three layers. The superior lays under the fornix. The intermediate is the vascular layer and contains the internal cerebral veins and the posteromedial choroidal arteries. The third forms the roof of the third ventricle and carries the chorioid plexus of the third ventricle. The transchoroidal approach goes through the tenia fornices, opens the tree layers of the tela chorioidea passing between the internal cerebral veins, without sacrificing vascular structures. In both patients it could be possible to reduce partially the tumor, empty the cysts, and leave an indwelling catheter with reservoir draining the cysts.
In one patient there is no relapse in 11 months. By the other, sporadic punctures (every 5-6 months) of the reservoir are needed to drain the cyst, when the patient becomes symptomatic, after 20 months of follow up.
Conclusion. The transchoroidal corridor is not the preferred election approach for the surgical treatment of craniopharyngiomas. However, in recidivant cases, postoperative and scar tissue in the tumoral loge may hinder the identification of vascular, nervous and functional structures; the selection a "virgin" approach that allows a correct identification of these structures is desirable. The transchoroidal corridor seems a valid alternative for the surgical treatment of some recidivant craniopharyngiomas.
Key words: Craniopharyngiomas; Transcallosal approach; Transchoroidal corridor; Third ventricle.
INTRODUCCIÓN
Numerosos autores han descripto a lo largo de la corta pero vasta historia de la Neurocirugía diferentes abordajes al III ventrículo. Históricamente, tres han sido los abordajes utilizados para acceder a la región anterior de esta estructura: el abordaje transcorticaltransventricular a través del lóbulo frontal, el abordaje transcalloso transventricular y el subfrontal a través de la lámina terminalis.
Nuestro objetivo es analizar someramente la anatomía del III ventrículo y revisar los corredores de la vía transcallosa hacia la parte anterior de esta cavidad, con motivo de la presentación del tratamiento de dos pacientes con craneofaringioma recidivado abordado por esta vía.
MATERIAL Y MÉTODOS
Se disecaron tres cerebros humanos formolizados e inyectados con látex con técnicas macroscópicas y de magnificación, describiendo la anatomía normal así como también el abordaje transcalloso con sus diferentes corredores.
Se analizan las historias clínicas, imágenes y resultados en dos pacientes tratados por vía transcallosa trasnscoroidea en el Hospital Militar Central de Buenos Aires.
RESULTADOS
Anatomía microquirúrgica del III ventrículo
El III ventrículo es una cavidad medial localizada por debajo y comunicada con los ventrículos laterales. Presenta una forma cuboidea describiéndose un piso y un techo, dos paredes laterales, una anterior y otra posterior (Fig.1).

Fig. 1. Corte sagital encefálico donde se evidencian: receso quiasmático (Ro); receso infundibular (Ri); cuerpos mamilares (Cm); adhesión intertalámica (Ci); foramen de Monro (Fm); arteria basilar (Ab); comisura posterior (Cp); mesencéfalo (M); glándula pineal (Gp); vena cerebral interna (Vci); art. posteromedial (AcPM); cuerpo calloso (Cc); art. pericallosa (Ap); septum; comisura anterior (Ca).
El piso se extiende desde el quiasma óptico anteriormente hasta el acueducto de Silvio posteriormente. Su mitad anterior está formada por estructuras diencefálicas: receso óptico e infundibular, tuber cinereum, cuerpos mamilares y sustancia perforada posterior. La mitad posterior la conforma el tegmento mesencefálico.
El techo ventricular clásicamente lo conforman cinco capas. La más superficial está constituida por el fórnix con la comisura hipocampal, estructura neural que une las dos cruras del fórnix en su parte más posterior. La segunda capa la forma la membrana superior de la tela coroidea; por debajo de ésta se halla la hoja vascular formada por las venas cerebrales internas y la arteria coroidea posteromedial (Fig. 2) y sus ramas. La cuarta, es la llamada membrana inferior de la tela coroidea; el espacio entre la hoja superior y la inferior es el denominado velum interpositum. La última capa está representada por el plexo coroideo que se continúa con el del ventrículo lateral.

Fig. 2. Preparado anatómico donde se evidencia a la arteria coroidea posteromedial (ACPM) acompañada de la vena cerebral interna (VCI) en relación con el techo del III ventrículo, transcurriendo por el receso suprapineal (RSP), situado inmediatamente superior a la glándula pineal (Pi).
Las paredes laterales la conforman ambos tálamos, existiendo un surco de importancia anatómica que va desde el foramen de Monro hasta la apertura del acueducto de Silvio. Al mismo se lo denomina surco hipotalámico, dividiendo al tercer ventrículo en dos partes; una superior (o talámica) y otra inferior (o hipotalámica).
La pared anterior se halla delimitada por el foramen de Monro superiormente y el quiasma óptico en su parte inferior. Está compuesta prácticamente en su totalidad por la lámina terminalis (Fig. 3). En su parte superior se agregan la comisura anterior y los pilares anteriores del trígono.

Fig. 3. Imagen donde se objetiva la pared anterior representada por la lámina terminalis (LT) en intima relación con el quiasma óptico, posterior a los nervios ópticos (NO), y medial y anterior a las cintillas ópticas (CO).
Por último la pared posterior se halla formada de superior a inferior por el receso suprapineal, la comisura habenular, la glándula pineal, el receso pineal, la comisura blanca posterior hasta llegar al acueducto de Silvio.
Corredores de la vía transcallosa anterior al III ventrículo
A fin de acceder al tercer ventrículo, se idearon numerosos corredores en la vía transcallosa, dependiendo la elección de la misma de la patología a tratar, el volumen de la lesión, el compromiso de estructuras vasculares y/o nerviosas, así como también de la preferencia y experiencia del cirujano. Estos corredores son: la vía transforaminal; la vía subcoroidal; la interforniceal y la transcoroidal.
Corredor transforaminal. Este corredor se utiliza para lesiones quísticas o semisólidas fácilmente resecables, que al igual de los otros corredores se realiza mediante la apertura de la cisterna interhemisférica y callosotomía ulterior (Fig. 4).

Fig. 4. Imagen donde se objetiva el cuerpo calloso (CC) y las arterias pericallosas (Pc) mediante la apertura de la cisterna interhemisférica.
Estas lesiones deben ser lo suficientemente anteriores como para poder ser extirpadas a través del foramen1,2. La exéresis de tumores más grandes que el foramen de Monro puede dañar la región paraforniceal. Algunos autores2 recomiendan ampliar esta vía a través de una mínima resección de la columna anterior del fórnix (introducida por Dandy) o sacrificando unilateralmente la vena talamoestriada (Fig. 5). Otros en cambio3 no lo recomiendan por considerar que dichas resecciones pueden provocar morbilidad en el postoperatorio. Dependiendo de las variantes anatómicas, la unión entre la vena septal y la vena cerebral interna puede variar entre 3 y 13 mm del margen posterior del foramen de Monro, lo que puede dificultar o facilitar su apertura según esta distancia.

Fig. 5. Preparado anatómico donde se muestra el plexo coroideo (Pc) transcurriendo por el ventrículo lateral derecho en busca del foramen interventricular (Fm), y su íntima relación con la vena talamoestriada (Vt) así como también con la arteria pericallosa (Ap) y la circunvolución del cíngulo (Cicc).
La resección del pilar anterior del fórnix puede provocar déficit de la memoria reciente, ya que el fórnix constituye una de las vías más importantes de conexión del sistema límbico con estructuras diencefálicas; particularmente en los casos en que la retracción intraoperatoria o la compresión tumoral se hace sobre el fórnix contralateral.
Corredor subcoroidal (o transvelum interpositum).
Este abordaje atraviesa la tenia thalami (o coroidea) (Fig. 6), teniendo como desventaja, el encontrarse atravesada por la vena talamoestriada, la vena talámica anterior y superior, lo que aumenta la posibilidad de lesión vascular. El plexo coroideo del ventrículo lateral desemboca en el foramen de Monro, el cual sirve como vía, debiendo ser coagulado y elevado, para exponer el tálamo4. El ingreso al tercer ventrículo se realiza por el extremo lateral (externo) de este plexo, llevándolo medialmente y disecando las adherencias aracnoidales del velum interpositum; atravesando ambas membranas de la tela coroidea. Esta maniobra puede dañar el tálamo, la estría talámica o ramos de la arteria coroidea posteromedial. La vena talamoestriada frecuentemente acompaña al plexo en el foramen de Monro; el sacrificio de la misma aún es discutible5. Si es necesario ampliar este corredor, esta maniobra de coagulación es preferible a manipular excesivamente la columna anterior del fórnix6. Otros autores como Yasargil no recomiendan la coagulación de esta vena, porque en algunos casos puede provocar hemiplejía, mutismo, infarto hemorrágico y/o muerte; dependiendo de la suplencia venosa de cada paciente.

Fig. 6. A. Corte axial a nivel del ventrículo lateral derecho donde se visualiza Pc: plexo coroideo; Cf: columna del fórnix; Paf: pilar anterior del fórnix; Vt: vena talamoestriada; T: tálamo; Cc: cuerpo calloso; Fm: foramen de Monro; Nc: núcleo caudado; VL: ventrículo lateral; Tc: tenia coroidea; Tf: tenia fornicis. Se observa la vía de abordaje subcoroidal (a través de la tenia coroideaflecha verde-) y la transcoroidal (a través de la tenia fornicisflecha roja-)
Corredor interfornicial. Descripta por Busch en 1944 a través de una vía transcortical, es el corredor de elección para lesiones grandes que no pueden ser resecadas por vía transforaminal. Más adelante, Apuzzo et al1 modificaron la técnica a través de una callosotomía anterior. Este abordaje contempla una apertura amplia del tercer ventrículo, permitiendo una manipulación bilateral del tumor a través de ambos forámenes y por la vía interforniceal. Una vez que el septum pellucidum es fenestrado, el rafe medio del techo ventricular puede ser abierto por un plano de clivaje natural. La razón de esta apertura separando sus dos hojas es que el fórnix se halla exactamente unido al septum en la línea media, por lo que su disección permite su separación sin daños a ambos fórnices.
Esta disección se ve limitada en su porción posterior por la comisura hipocampal. La retracción excesiva de ambos fórnices o de la comisura anterior trae como consecuencia déficit transitorio de la memoria reciente.
Corredor transcoroidal. Una vez identificado el plexo coroideo de los ventrículos laterales, se localiza la tenia fornicis, que une el plexo con el pilar anterior del fórnix. Esta hoja es luego abierta para acceder a la fisura coroidea7,8. Se abre posteriormente la membrana superior de la tela coroidea y al ingresar al velum interpositum se diseca la membrana inferior de la tela. En esta parte de la cirugía es importante recordar que la apertura de esta membrana se debe hacer siempre entre las venas cerebrales internas, ya que las mismas no presentan venas de drenaje interpuestas lo que facilita su separación (Nagata et al). De esta forma el límite posterior del foramen de Monro ha sido expandido a través de la fisura coroidea, sin sacrificio de estructuras vasculares o neurales. De ser necesario la ampliación de esta fisura, puede coagularse la vena septal anterior sin perjuicio del drenaje venoso profundo y con escasa posibilidad de morbilidad postoperatoria (Fig. 7).

Fig. 7. Preparado en el que se disecó el núcleo caudado derecho (NCD), realizándose una exéresis parcial talámica anterior izquierda, lográndose objetivar la fisura coroidea derecha (Fc); la vena tálamo estriada derecha (VTE) y sus afluentes, el foramen interventricular (Fm) en relación con el plexo coroideo (Pc), donde se evidencian las flexuosidades de la vena del plexo coroideo.
DESCRIPCIÓN
Caso 1
Paciente de 24 años con diagnóstico anatomopatológico de craneofaringioma adantimomatoso operado en una ocasión por vía frontotemporal derecha. Paciente abúlico y apático, panhipopituitario, con hemiparesia 4/5 izquierda secuelar y midriasis arreactiva y ptosis palpebral parcial (III par incompleto) en ojo derecho, que ingresa por empeoramiento de agudeza visual en ambos ojos, cefalea y somnolencia leve de 7 días de evolución. En estudios por imágenes se objetiva recidiva de componente sólido y quístico con extensión supraselar hasta el foramen de Monro, deformando completamente el III ventrículo. A su vez presenta extensión hacia la porción rostral de la cisterna prepontina e interpeduncular, provocando una importante compresión y desplazamiento del mesencéfalo y protuberancia (Figs. 8 y 9), en particular del lado derecho.
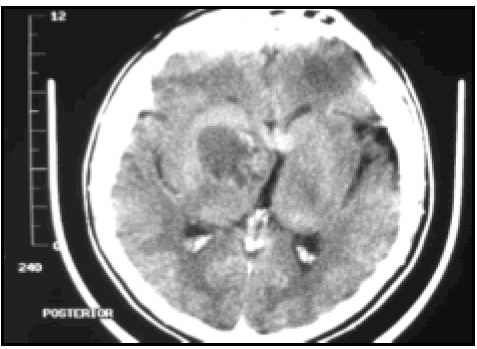
Fig. 8. Imagen de TAC preoperatoria.

Fig. 9. IRM preoperatoria corte sagital

Fig. 10. Imagen postoperatoria. Reducción del componente sólido y quístico.

Fig. 11. Catéter intraquístico colocado por vía transcoroidal. Corte coronal ponderado en T2.
Caso 2
Paciente de 29 años con diagnóstico anatomopatológico de craneofaringioma adantimomatoso operado en tres ocasiones por vía frontotemporal derecha dos veces y subfrontal la restante, braquiterapia y tratamiento quimioterápico intratumoral con bleomicina. Paciente con panhipopituitarismo, con reemplazo hormonal total. Presenta amaurosis de ojo izquierdo, hemianopsia temporal derecha que ingresa por empeoramiento de agudeza visual en ojo derecho, cefalea y vómitos 2 días de evolución. En estudios por imágenes se objetiva recidiva de componente sólido y quístico con extensión supraselar hasta ventrículo lateral deformando completamente el III ventrículo (Figs. 12 y 13).

Fig. 12. IRM preoperatorias. Corte coronal.

Fig. 13. IRM preoperatorios. Cortes axiales. Samii V - Yasargil F.
Se realizó un abordaje transcalloso por vía transcoroidal, donde se logró exéresis parcial de componente sólido y se colocó catéter intraquístico para punción posterior (Figs. 14, 15 y 16).

Fig. 14. IRM en T2 mostrando trayecto de catéter y su ubicación intraquistica mediante abordaje transcalloso.

Fig. 15. IRM en T2 coronal evidenciando trayecto del abordaje por vía transcoroidal.

Fig. 16. Imagen operatoria. A. Visualización del cuerpo calloso (CC), cíngulo (C) y arterias pericallosas (ACM). B. Callosotomía anterior de 2,5 cm.
Ambos pacientes evolucionaron favorablemente, actualmente en un caso no se observó recidiva con un seguimiento de 11 meses. En el otro caso se realizan punciones cada 4-5 meses para vaciamiento del quiste, por presentar cefalea y disminución de la agudeza visual (seguimiento 20 meses).
DISCUSIÓN
Cushing describió la resección de los craneofaringiomas como un "baffling problem" (problema desconcertante) para los neurocirujanos.
Aunque histológicamente benignos y de crecimiento lento, los craneofaringiomas presentan adherencias firmes al tallo infundibular, quiasma óptico e hipotálamo que predisponen a un sinnúmero de síntomas neurológicos, visuales y endocrinológicos. A pesar de los avances en el campo de la radiocirugía, la resección quirúrgica total sigue siendo el "gold standard" del tratamiento, y el más relevante en el pronóstico a largo plazo de estos pacientes.
El éxito de la resección total con mínimos o nulos déficit postoperatorios, depende de numerosos factores, entre ellos se destacan el volumen y la ubicación tumoral. Estas variables fueron bien estudiadas por Yasargil9,10 (Fig. 17) y Samii 11 (Fig. 18); los cuales idearon sistemas de clasificación a fin de normatizar y facilitar el tratamiento quirúrgico de estos tumores. Sin dudas, la experiencia y conocimiento de la anatomía microquirúrgica de la región son otros factores a tener en cuenta.

Fig. 17. Clasificación de Yasargil. A: puramente intraselar e infradiafragmático. B: intra y supraselar, infra y supradiafragmático. C: supradiafragmático, paraquiasmático y extraventricular. D: intra y extraventricular. E: paraventricular con respecto al 3er ventrículo. F: puramente intraventricular.

Fig. 18. Clasificación de Samii. I: intraselar. II: intracisternal con o sin compromiso intraselar. III: intracisternal con compromiso de la mitad inferior del 3er ventrículo. IV: intracisternal con compromiso de la mitad superior del 3er ventrículo. V: intracisternal con compromiso del septum pellucidum y/o ventrículos laterales.
Está descripto en la literatura12-14 que la tasa de recurrencia aumenta dramáticamente en los casos de craneofaringiomas resecados en forma incompleta; principalmente aquellos tumores mayores de 4 cm, con firmes adherencias hipotalámicas y a vasos perforantes. Se calcula que la tasa libre de recurrencia a los 10 años es de un 83% luego de la resección total, de un 50,5% después de una exéresis subtotal, y de tan sólo un 15,6% en resecciones parciales.
Dos opciones pueden ser consideradas15 en caso de tumores recurrentes: una Segunda cirugía con exéresis total o subtotal según el tamaño y compromiso de estructuras nobles, con posterior radioterapia; o la radioterapia o radiocirugía sola. Es conocido en la literatura que una segunda cirugía acarrea un mayor morbimortalidad con bajas probabilidades de cura.
Muchos han sido los abordajes propuestos para el tratamiento quirúrgico de estas lesiones. El abordaje elegido depende principalmente de la extensión del tumor, y debería ser lo suficientemente adecuado para permitir una exposición amplia del mismo; en el trayecto más corto, con la menor retracción cerebral posible y con un control preciso de las estructuras neurovasculares circundantes12.
En la literatura14 se los divide en: abordajes de línea media anteriores, como ser el subfrontal trans lámina terminalis y el transeptoesfenoidal; los anterolaterales como son el pterional y el orbitozigomático; y los intraventriculares, ya sea transcallosos como transcorticales.
Greenwood, en 1949, fue uno de los primeros en describir la vía transcallosa, aún sin el desarrollo de las técnicas microquirúrgicas con las que se cuenta hoy en día. Las ventajas16 del abordaje transcalloso son: un trayecto relativamente corto en comparación con la vía transcortical; cierta flexibilidad para explorar el III ventrículo, sin agresión cortical y con menos posibilidades de convulsiones postoperatorias; excelente visión profunda con exposición bilateral de ambos forámenes de Monro y por último, no es necesaria una ventriculomegalia asociada ya que el abordaje no depende del tamaño ventricular.
Cuando la exposición a través del foramen de Monro es limitada17, puede optarse por ampliar el acceso al III ventrículo atravesando los corredores subcoroidal, transcoroidal o interforniceal. A su vez, este abordaje puede combinarse con los descritos anteriormente para resecar el componente extraventricular y basal de la lesión. Las complicaciones descritas en la literatura18,19 de este abordaje son: la ruptura de venas de drenaje al seno longitudinal superior; la aparición de mutismo por la excesiva retracción de ambas circunvoluciones del cíngulo; alteraciones de la memoria a corto plazo por retracción del fórnix (hasta en dos tercios de los pacientes), afasias y astereoagnosias. Así como también lesiones de la circulación venosa profunda.
La vía transcallosa nos pareció una alternativa válida para estos casos de craneofaringioma recidivado con gran extensión supraselar e intraventricular, ya que una reoperación a través de un acceso "virgen" disminuye la posibilidad de complicaciones y permite la liberación de estructuras comprometidas, facilitando además, la colocación de catéteres intraquísticos que mejoren el manejo postoperatorio de estos pacientes.
CONCLUSIÓN
Los craneofaringiomas recidivados constituyen un gran desafío quirúrgico, más aún cuando existen cicatrices y adherencias postoperatorias que dificultan el acceso quirúrgico e incrementan el riesgo de complicaciones. La vía transcallosa a través de cualquiera de los corredores, elegido según la experiencia del cirujano, es un abordaje alternativo seguro y anatómico para el tratamiento de los craneofaringiomas recidivados.
Agradecimientos
Se agradece la colaboración del Prof. Dr. Bianchi en la facilitación de material cadavérico y el trabajo en conjunto con el personal del laboratorio de Neuroanatomía de la 3ra Cátedra de Anatomía de la Facultad de Medicina de la UBA.
Bibliografía
1. Apuzzo MLJ, Giannotta SL. Transcallosal interforniceal approach. In: Apuzzo: Surgery of the ventricle region. Baltimore- William & Wilkins; 1987: 354-80.
2. Ehni G, Ehni B. Considerations in transforaminal entry, in Apuzzo (ed): Surgery of the ventricle region. Baltimore- William & Wilkins, 1987.
3. Ture U, Yasargil MG, Ossama Al Mefty. The transcallosal transforaminal approach to the third ventricle. J Neurosurg 1997; 87: 706-15.
4. Lavyne MH, Patterson RH. Subchoroidal transvelum interpositum approach to mid-third ventricular tumors. Neurosurgery 1983; 12: 86-94.
5. Ono M, Rothon AL, Peace D. Microsurgical anatomy of the deep venous system of the brain. Neurosurgery 1984; 15: 621-57.
6. Viale GL, Turtas S. The subchoroidal approach to the third ventricle. Surg Neurol 1980; 14: 71-6.
7. Wen HT, Rothon AL, de Oliveira E. Transchoroidal approach to the third ventricle: an anatomic study of the choroidal fissure and its clinical application. Neurosurgery 1998; 42: 1205-19.
8. Yamamoto I, Rothon AL, Peace D. Microsurgery of the third ventricle. Neurosurgery 1981; 8: 334-56.
9. Yasargil MG, Curcic M, Kis M. Total removal of craniopharyngiomas. Approaches and long-term results in 144 patients. J Neurosurg 1990; 73: 3-11.
10. Yasargil MG. Microneurosurgery: Microneurosurgery of CNS Tumors. Vol 4B. Stuttgart/New York: Georg Thieme Verlag; 1996: pp. 29-68.
11. Samii M, Samii A. Surgery of large craniopharyngiomas. J Neurosurg 1994; XXXXX.
12. Falbusch R, Honegger J, Paulus W, Huk W, Buchfelder M. Surgical treatment of craniopharyngiomas. Part I. Experience with 168 patients. J Neurosurg 1999; 90(2): 237-50.
13. Kobayashi T. Recent progress in the treatment of craniopharyngiomas. Neurosurgery 1984; 3: 101-12.
14. Liu JK, Chad DC, John RWK, Douglas LB, Walker ML. Cranial base strategies for resection of craniopharyngiomas in children. Neurosurg Focus 2005; 18(6): E9 review.
15. Puget S, Garnett FR, Wray, AF. Pediatric craniopharyngiomas: classification and treatment according to the degree of hypothalamic involvement. J Neurosurg (Suppl Pediatrics) 2007; 106: 3- 12.18.
16. Stein, BM. Transcallosal approach to tumors of third ventricle. En: Schmidek HH, Sweet WH. Operative Neurosurgical Techniques: Indications, Methods and Result. Vol 1. Grune & Stratton; 1988: 389-95.
17. Long DM; Leibrock L. The transcallosal approach to the anterior ventricular system and its application in the therapy of craniopharyngiomas. Clin Neurosurg 1980; 27: 160-8.
18. Heilman KM, Sypert GW. Korsakoff's syndrome resulting from bilateral fórnix lesions. Neurology 1977; 27: 490.
19. Jeeves MA, Simpson, DA, Geffen G. Functional consequences of the transcallosal removal of intraventricular tumors. J Neurol Neurosurg Psychiatry 1970; 42: 134-42.
COMENTARIO
Los autores presentan una completa y acertada revisión de los abordajes a la región anterior del tercer ventrículo que han sido descriptos. Se estudiaron 3 cerebros formolizados e inyectados con látex, en los cuales se practicaron los abordajes transcallosos al tercer ventrículo anterior mediante las vías transforaminal, subcoroidea, interforniceal y transcoroidea (esta traducción me parece más acertada que el anglicismo "transcoroidal"). Se operaron, además, 2 pacientes complejos con craneofaringiomas gigantes recidivantes operados previamente por otras vías, empleando el abordaje transcalloso transcoroideo con buenos resultados. Creemos que la elección de la vía de abordaje fue la correcta: el abordaje transcalloso puede efectuarse en ventrículos sin dilatación, si el foramen de Monro está dilatado puede extirparse la lesión a través del mismo.
En caso de que la exposición resulte insuficiente, puede ampliarse la misma por vía transcoroidea, no es aconsejable la sección del pilar anterior del fórnix, como alguna vez se propuso.
De acuerdo a Rhoton, es preferible la apertura de la fisura coroidea siguiendo la tenia fórnices, no la tenia coroidea o talámica. En ambos casos, debe evitarse la lesión del cuerpo del fórnix y del núcleo dorsomediano del tálamo; este último recibe aferencias del núcleo amigdalino y de la neocorteza temporal y se proyecta hacia la corteza prefrontal. Su lesión puede producir cambios emocionales, similares a los producidos por lesión de la corteza orbitofrontal, y también alteraciones mnésicas, difíciles de diferenciar de las causadas por lesión del fórnix.
La discusión del trabajo es concisa y precisa y presenta las clasificaciones de craneofaringiomas de Yasargil y de Samii.
Antonio Carrizo
