Título
Autor
Lugar de Realización
Correspondencia
Texto
Rev Argent Neuroc 2012; 26: 119
CIRUGÍA DE EPILEPSIA LESIONAL EN NIÑOS Y ADOLESCENTES
Julio C. Suárez1, Claudio Palacios3, Enrique Herrera2, Francisco Pueryrredon1, A. Surur4, Ricardo Theaux5, María S. Suárez6, Juan M. Ryan1, Juan C. Viano2.
1Departamento de Neurocirugía del Sanatorio Allende. 2Departamento de Neurocirugía del Sanatorio Allende y del Hospital Infantil Municipal. 3Departamento de Neurología Infantil del Sanatorio Allende y del Hospital Infantil Municipal. 4Departamento de Neurradiología del Sanatorio Allende. 5Departamento de Neuropatología. Facultad de Medicina. Universidad Católica de Córdoba. 6Departamento de Neuropsicología del Sanatorio Allende.
RESUMEN
Objetivo. Presentar nuestra experiencia de 20 años en cirugía de epilepsia lesional en pediatría.
Población y método. Estudio retrospectivo basado en historias clínicas de pacientes con epilepsia operados entre enero de 1990 y diciembre de 2009 en el Sanatorio Allende y el Hospital Infantil de Córdoba.
Resultados. 46 niños menores de 15 años fueron incluidos: 32 tumores (67,3%), 5 cavernomas, 2 displasias corticales, 2 gliosis mesiales, una gliosis mesi al asociada a displasia, una malformación arteriovenosa, un síndrome de Rassmüssen , una gliosis debido a traumatismo de cráneo y un paciente con historia de encefalitis. La localización fue temporal en 20 casos (43,4%) y extratemporal en 26 (56,5%). Entre el inicio de las crisis y la cirugía hubo en promedio 31,1 meses. 41 casos fueron tratados mediante exéresis quirúrgica y 5 casos mediante braquiterapia con I125. No hubo mortalidad quirúrgica.
Discusión. El tratamiento fue satisfactorio si analizamos el control de las crisis convulsivas (incluso en casos de braquiterapia). Actualmente de los 44 pacientes que viven 43 están libre de crisis convulsivas discapacitantes, 34 de ellos tienen un EEG normal y 22 están sin medicación anticonuulsiva.
Conclusión. En nuestra serie los pacientes con tumores de cerebro tuvieron un buen control de las convulsiones luego de la resección tumoral. Buenos resultados también se observaron en patología no tumoral.
Palabras clave: epilepsia lesional, niños, tumores, displasia, cavernoma.
Correspondencia:
totoralar@yahoo.com
Recibido: junio de 2012.
Aprobado: julio de 2012.
INTRODUCCIÓN
Una crisis convulsiva es un episodio transitorio de signos y/o síntomas debidos a una excesiva o anormal actividad del cerebro1. Para hablar de epilepsia se necesita por lo menos la ocurrencia de una o más crisis convulsivas1. La epilepsia incluye a una variedad de patologías que originan disfunción neuronal1.
Estudios epidemiológicos indican que la incidencia de convulsiones y epilepsia es mayor en niños que en adultos2. La incidencia de convulsiones en niños es de 4-6% y de epilepsia de cerca de 1%3. Un 20% de pacientes pediátricos se vuelve resistente a la terapia con anticonvulsivantes4. Para éstos la cirugía de la epilepsia se convierte en una alternativa válida de tratamiento5. En los pacientes con epilepsia refractaria, candidatos a cirugía, se debe: confirmar la naturaleza epileptogénica de las crisis, confirmar la refractariedad de las mismas, localizar la zona epileptogénica, y constatar que la misma coincida o este cerca de la lesión6.
Se habla de epilepsia lesional cuando los estudios de imágenes detectan anormalidades estructurales causales de las crisis. En la población pediátrica las etiologías predominantes son las displasias corticales focales, multilobares o hemisféricas, y los tumores de bajo grado. Causas menos comunes son las malformaciones vasculares, los quistes aracnoideos y lesiones focales secundarias a isquemia, trauma o infección7.
El objetivo de este estudio es presentar nuestra experiencia en cirugía de niños con epilepsia lesional durante 20 años.
POBLACIÓN Y MÉTODO
Se realizó un estudio retrospectivo, basado en historias clínicas de pacientes con epilepsia operados en el Sanatorio Allende y el Hospital Infantil de Córdoba entre enero de 1990 y diciembre de 2009. Se incluyeron 46 niños menores de 15 años.
En la evaluación postoperatoria de las crisis convulsivas, de los niños con epilepsia refractaria, se utilizó la clasificación de Engel, que tiene en cuenta el tipo, número y frecuencia de convulsiones que todavía presentan los pacientes después de una cirugía de epilepsia8 (tabla 1).
Tabla 1. Clasificación postoperatoria de Engel
|
Clase I: Libre de crisis discapacitantes* |
RESULTADOS
La edad media al momento de la consulta fue de 9 años y 5 meses, con una mediana de 10 años y 3 meses, y un rango entre 9 meses y 180 meses.
Los pacientes presentaron diferentes tipos de crisis epilépticas: parcial continua en un caso (Síndrome de Rassmüssen), parcial simple en 8 casos, parcial compleja en 26 casos y tónico-clónica generalizada en 11 pacientes. Las crisis eran polimórficas en 10 casos y monomórficas en los restantes 36. El promedio de crisis convulsivas en pacientes con tumores fue de 1 crisis cada 2 meses; en pacientes con cavernomas una crisis al mes; en pacientes con gliosis de 2,5 crisis por mes, en un paciente con gliosis mesial de 1,5 crisis por mes y en el otro de 7 mensuales; el paciente con encefalitis tenía un promedio de 15 crisis por mes.
La edad media al comienzo de la epilepsia fue de 6 años y medio, la mediana de 6 años y 2 meses y el rango de 2 a 170 meses. Desde el inicio de las crisis hasta la cirugía pasaron en promedio 31,3 meses, con una mediana dé 18 meses y un rango de 2 a 153 meses. Considerando sólo los pacientes con tumores (32) encontramos una duración de la epilepsia previa a la cirugía de 26 meses de media, 17 meses de mediana, con una moda de 12 meses y un rango de 2 a 120 meses. Si tomamos en cuenta los pacientes operados antes del ario 2000 (n=16) encontramos una media de evolución de la epilepsia previo a la cirugía de 34,87 meses (mediana de 21 meses), frente a una media de 29,1 meses (mediana de 12 meses) encontrada en los pacientes operados luego de esa fecha (n=30). Probablemente esto se deba a un diagnóstico más temprano gracias a las modernas técnicas de imagen y a una mayor concientización de los beneficios de la cirugía.
En la tabla 2 puede observarse cuántos medicamentos anticonvulsivos habían tomado los pacientes.
De los 46 pacientes, 12 tenían epilepsia refractaria a la medicación, con una media de 36,2 meses el tiempo de evolución de las crisis, y con un rango entre 12 y 126 meses. De ellos: 4 habían tomado dos anticonvulsivantes, 5 tres medicamentos y 3 enfermos habían tomado más de tres fármacos antiepilépticos.
Los estudios por imágenes realizados fueron: tomografía en 30 casos, resonancia cerebral en 42, resonancia con espectroscopia en 4, resonancia funcional en 3 y arteriografía cerebral en 13 pacientes.
Tabla 2. Medicamentos utilizados antes de la cirugía
| Fenitoína | 34 |
| Carbamacepina | 26 |
| Acido valproico | 15 |
| Fanobarbital | 12 |
| Oxcarbarnazepina | 5 |
| Levetiracetam | 3 |
| Lamotrigina | 1 |
| Clobazam | 1 |
Los estudios neurofisiológicos realizados fueron: EEG de superficie (en todos los casos), video-EEG 7 pacientes (2 con displasia, 2 con oligodendrogliomas, 1 con displasia asociada a tumor neuroglial, 1 síndrome de Rassmüssen y 1 paciente con antecedente de encefalitis), EEG con grillas subdurales un caso (con displasia cortical) y electrocorticografia intraoperatoria 4 casos (3 de ellos fueron reintervenciones por recidiva tumoral con crisis convulsivas y el otro se trataba de una displasia parietooccipital izquierda). Estos últimos estudios permiten identificar adecuadamente el área epileptogénica, que no siempre coincide en su totalidad con el área lesional (ubicándose muchas veces en la vecindad de la misma).
En cuanto a la localización, 20 casos fueron lesiones del lóbulo temporal (43,3%) y 26 casos extratemporales (56,5%), de las cuáles 17 fueron frontales, 4 occipitales, 3 parietales, 1 talámico y 1 del núcleo caudado (Fig. 1).
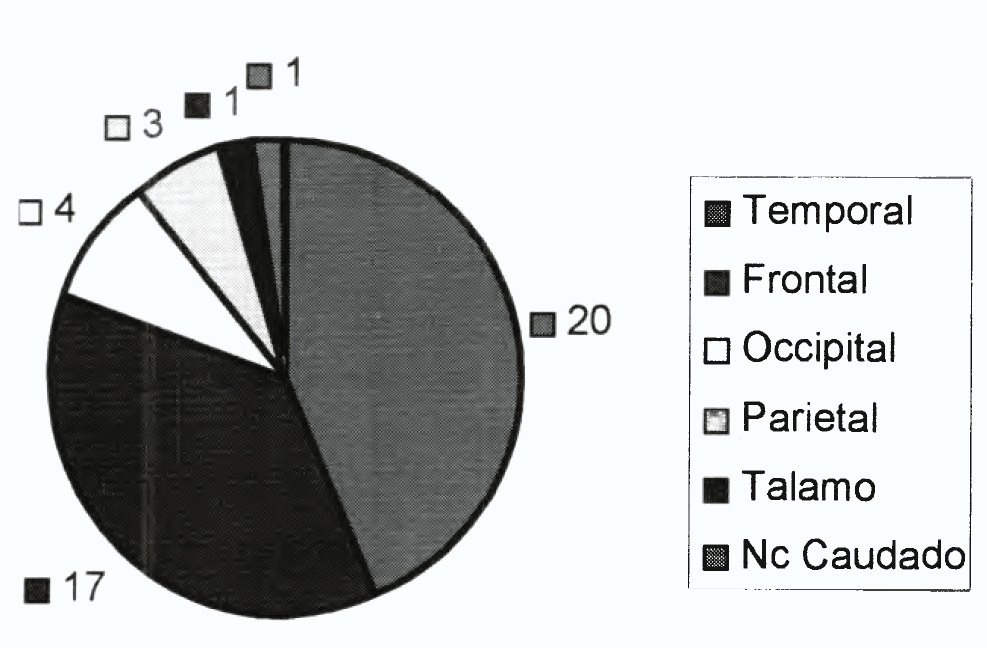
Fig. 1. Localización lesional
La histopatología mostró 32 (67,3%) tumores cerebrales, 6 (13%) casos de patología vasculocerebral (5 cavernomas y una malformación arteriovenosa frontal derecha), 3 (6,5%) casos de anomalías del desarrollo cortical (uno asociado a gliosis mesial y otro asociado a tumor neuroglial), 2 (4,3%) casos de gliosis mesial, un caso síndrome de Rassmüssen, uno de encefalitis y uno de traumatismo craneoencefálico (tabla 3).
De los 32 tumores (67,3%) (tabla 3), fueron 25 gliales (astrocitomas, oligodendrogliomas) y 7 neurogliales (gangliogliomas y tumor neuroepitelial disembrioplásico), este último se presentó asociado a displasia cortical.
Tabla 3. Origen de las convulsiones
| Tumores | 32 |
| Cavernomas | 5 |
| Displacias | 3 |
| Gliosis mesial | 1 |
| Gliosis mesial más displasias | 1 |
| MAV | 1 |
| Rassmüssen | 1 |
| Contusión traumática | 1 |
| Encefalitis | 1 |
De los 46 casos, 41 fueron tratados con cirugía y 5 casos con braquitera pía con yodo 125; de los 41 operados en 35 la exéresis fue total y en 6 subtotal; de éstos 5 casos tuvieron que ser reintervenidos por recidiva de la epilepsia (en 3 la exéresis fue con electrocorticografía intraoperatoria, y en 2 se hizo braquiterapia, por la ubicación de la lesión).
El resultado del tratamiento quirúrgico en general (incluidos enfermos con cirugía convencional y enfermos con braquiterapia) fue bueno desde el punto de vista de la epilepsia.
De los 12 enfermos con epilepsia refractaria 9 tienen un Engel JA, (incluido el paciente que falleció a los 3 meses de ser operados de un Síndrome de Rasmüssen), dos un Engel IB, en 1 el Engel fue IVB (el paciente que tuvo encefalitis).
No hubo mortalidad operatoria. Fallecieron dos pacientes (4,3%), uno por recidiva de un ganglioglioma anaplásico, a los 4 arios de la cirugía, sin recidiva de la epilepsia, y el segundo caso falleció de una neumonía broncoaspirativa, a los 3 meses de una hemiferostomía por síndrome de Rassmüssen, también sin recidiva de la epilepsia.
En el momento actual, de los 44 niños que viven, sólo uno presenta crisis convulsivas discapacitantes, (el niño con un Engel IVB); 20 no toman anticonvulsivantes y 14 sí; en 34 enfermos el EEG es normal y sólo 10 tienen un trazado anormal.
DISCUSIÓN
En esta serie la localización extratemporal fue la más importante (56%), coincidente con otros autores9. En 26 niños las crisis fueron parciales complejas, originadas en un área extra-temporal en el 16% de los casos; las lesiones extra-temporales se expresaron con crisis parciales complejas en el 74% de los pacientes10.
En esta serie las causas más frecuentes fueron tumores de bajo grado y malformaciones vasculares. Las etiologías menos comunes fueron las malformaciones del desarrollo cortical, la gliosis mesial, la infección y el trauma craneoencefálico.
Tumores
La epilepsia es una manifestación clínica frecuente en niños con tumores cerebrales. En éste grupo etano las neoplasias de bajo grado son la causa del 10 al 30% de epilepsia parcial crónica intratable. La convulsión es el primer síntoma en el 50% de los tumores astrogliales10,11. La mayoría de los tumores hemisféricos supratentoriales en la niñez son gliomas, de los cuales los de bajo grado o grado II (OMS) constituyen la mayoría12.
La categoría de tumores neurales y neurogliales incluye a los tumores neuroepiteliales disembrioplásicos, a los gangliogliomas, y a los gangliocitomas, que corresponde a los grado I de la OMS; esta variedad de neoplasia se asocia frecuentemente a historia de convulsiones que oscila entre 1 mes y 50 arios antes del diagnóstico, con una mediana/mediana de 6 a 25 años13. La historia de convulsiones en nuestra serie tuvo un rango de 6 a 69 meses con un promedio de 22 meses y una media de 12 meses. Se ha demostrado que la hiperexitabilidad de la corteza cerebral vecina al nódulo tumoral en los gliomas de bajo grado esta dada por una significativa disminución del ácido gammaaminobutírico y de la somatoestatina en esa población neuronal, comparadas con las neuronas alejadas del tumor en el mismo paciente14.
Tanto en los gliomas de bajo grado como en los tumores neurogliales de la infancia la extensión de la exéresis tumoral es un factor pronóstico importante en la sobrevida de estos enfermos13,14.
Los gangliogliomas son tumores benignos que pueden evolucionar a la anaplasia en su componente glial con una conducta histológica y biológica similar a los gliomas de alto grado15.
La braquiterapia con Yodo125 (radiocirugía intersticial) es un procedimiento que puede emplearse en el tratamiento de tumores cerebrales ubicados en estructuras profundas o áreas elocuentes del cerebro y, en nuestra serie ha dado buenos resultados16,17.
Malformaciones vasculares
A menudo las convulsiones son la única expresión clínica de los angiomas cavernosos de cerebro; se observan entre el 50 y el 70% de los casos, a diferencia de las malformaciones arteriovenosas en las que representan entre el 20 y 40% y de los gliomas cerebrales en los cuales se las observa entre el 10 y 30% de los casos18.
Los angiomas cavernosos del cerebro ejercen un efecto patológico en el parénquima cerebral vecino, creando una zona epileptogénico. Dicho efecto puede ser de origen mecánico (presión o isquemia) o por la acción de factores tráficos específicos como la hemosiderosis18.
Anormalidades del desarrollo cortical
Malformaciones causadas por anormalidades en el desarrollo cortical, también conocidas como desórdenes en el desarrollo cortical, displasias corticales, disgenesias corticales o desordenes de la migración neuronal, son reconocidas como una de las principales causas de epilepsia refractaria a la medicación. Esta anomalía en el desarrollo incide en la formación de los surcos y circunvoluciones cerebrales con desórdenes en la organización de la corteza cerebral19-21.
La resección quirúrgica de la zona epileptógena requiere de su exacta localización preoperatoria, por esa razón en uno de los casos de nuestra serie se utilizaron electrodos subdurales, colocados a través de una craneotomía abierta. La técnica con electrodos subdurales extraoperatorios crónica permite el registro del área ictal y conocer la funcionalidad de la corteza cerebral subyacente22,23. La resección de la corteza con malformación del desarrollo continúa siendo el tratamiento de elección en los pacientes con epilepsia focal farmacorresistente. Dado que la zona epileptogénica comúnmente excede los límites de dicha anomalía, la estricta cirugía de la misma torna insuficiente el procedimiento para el tratamiento de la epilepsia. Por esa razón es de mucha utilidad la electrocorticografía intraoperatoria22.
La eficacia de la cirugía para el manejo de anomalías del desarrollo cortical permanece desconocida. Varias series de la literatura publican repuestas menos favorables comparadas con la gliosis mesial y con la epilepsia por tumores de bajo grado22,24,25.
En nuestra serie dos paciente tenían malformación del desarrollo cortical asociada con gliosis mesial en un caso y con tumor neuroepitelial disembrioplásico en el otro. La gliosis mesial se asocia a una lesión del desarrollo entre el 15 y 30% de los casos, fenómeno denominado patología dual. Al respecto los estudios retrospectivos indican que la resección de ambas lesiones tiene mejor resultado comparada con la exéresis de un sola de las estructuras afectadas26-28.
El tumor neuroepitelial disembrioplásico fue descrito como una entidad patológica en 1988 por Daumas- Duport et al29. Es una lesión ubicada comúnmente en el área de epilepsia crónica. Tiene una estructura. multinodular de localización predominantemente cortical. Se suele asociar a malformaciones del desarrollo cortica', lo que sugiere una base malformativa en esta variedad de tumorl10,30.
Gliosis mesial
Nosotros tuvimos 2 pacientes (4,3%) con gliosis mesial o esclerosis hipocampal, que es la patología frecuentemente encontrada en la epilepsia temporomesial. Se la define como una pérdida neuronal, gliosis y reorganización26,31. En la serie pediátrica de la Cleveland Clinic la resección del foco epiléptico temporomesial tiene una mejor evolución (78%) que la observada en las resecciones extra-temporales o multilobares (54%)7.
Epilepsia postraumática
La epilepsia post traumática tiene una prevalencia del 5% y es una de las más difíciles para predecir complicaciones32. La incidencia de convulsiones post traumáticas es mayor en niños que en adultos porque el cerebro del infante es mas susceptible a las convulsiones por eventos traumáticos al ser un cerebro en crecimiento33,34.
El trauma produce en el cerebro cambios estructurales, fisiológicos y biomecánicos, causados por la fuerza que ejercen la aceleración y la rotación sobre los tractos fibrosos, con ruptura de vasos y daño axonal difuso caracterizado por gliosís, cicatrices microgliales, retracción axonal, y degeneración Walleriana34. Otro mecanismo descripto es la acción de la hemosiderina sobre el parénquima cerebral, especialmente sobre la corteza cerebral debido a la acción de hierro34,35.
CONCLUSIÓN
La epilepsia lesional tumoral, como la epilepsia lesional refractaria, deben ser operadas precozmente para evitar los efectos neuronales deletéreos de las crisis y los efectos neurotóxicos de los anticonvulsivantes. En esta serie el resultado del tratamiento quirúrgico fue bueno desde el punto de vista de la epilepsia, especialmente en los enfermos con tumores cerebrales. De los 12 enfermos con epilepsia refractaria 9 tienen un Engel JA, (incluido el paciente que falleció a los 3 meses de ser operados de un Síndrome de Rasmüssen), dos un Engel IB, en 1 el Engel fue IVB (el paciente que tuvo encefalitis).
Bibliografía
- Fisher RS, Van Emde Boas W, Biume W, Elger C, Genton P, Lee P, Engerl J (Jr). Epileptic Seizures and Epilepsy: Definitions Proposed by the International League Against Epilepsy (ILAE) and the International Bureau for Epilepsy (IBE). Epilepsia 2005; 46 (40): 470-2.
- Hauser WA, Duriand LT. The epiderniolou of epilepsy in Rochester, Minnesota. Epilepsia 1975; 16: 1-66.
- Cowan LD, Bodensteiner JB, Leviton A, Doherty L. Prevalence of the epilepsies in children and adolescents. Epilepsia 1989; 30: 94-106.
- National Institutes of Health. Surgery for epilepsy. Consens Statement 1990; 8: 1- 20.
- Laux L, Nordli Jr, DR. Evaluation of Intractable Epilepsy-. In: Albright AL, Pollack 1F, Adelson PD (eds): Principies and Practice of Pediatric Neurosurgery. Thieme. New York. 2008; 1045 - 55.
- Olson DM. Evaluation of Children for Epilepsy Surgery. Pediatric Neurosurgery. 2001; 134: 159-65.
- Gupta A, Wyllie E, Bingarnan WE (2006) .Epilepsy surgery in in fants and children. In: Wyllie E, Gupta A, Lachhwani DK (eds): The Treatment of Epilepsy. Principies & Practice. Lippincott Williams & Wilkins. Fourth Edition. Philadelphia. 2006: 1143-57.
- Engel J (Jr), Van Ness PC, Rasmussen TB, Ojeman LM': Outcome with Respect to Epileptic Seizures. In: Engel J (Jr) (ed): Surgical Treatment of the Epilepsies. Rayen Press. New York. 1993. Chapter 52, pp. 609-21d.
- Pomata HB, González R, Bartuluchi M, Petre C, Ciraoio C, Caraballo R, Cersócimo R et al. Extratemporal epilepsy- in children: candidate selection and surgical treatment. Child's Nerv Syst 2000; 16: 842-50.
- Prayson RA Patholow- ofEpileptogenic Neoplasms. In: LüdersHO (ed): Epilepsy Surgery-. Informa Healthcar. London. 2008:1373-83.
- Spencer DD, Carpentier AC (2006). Resection for Uncontrolled Epilepsy in the Setting of Focal Lesion on MRI: Tumor, Vascular Malformation, Trauma, and Infarction. In: Wyllie E (ed): The Treatment of Epilepsy. Lippincott 'Williams & Wilkins. Fourth Edition, Philadelphia. 2006: 1087-101.
- Pollack IF. Supratentorial Hemispheric °lomas. In: Albrigh AL, Pollack IF, Adelson PD (eds): Principies and Practice of Pediatric Neurosurgery. Second Edition. Thieme. New York. 2008: 511- 30.
- Mapstone TB: Supratentorial Hemispheric Nonglial Neoplasms. In: Albright AL, Pollack IF, Adelson PD (eds): Principies and Practice of Pediatric Neurosurgery. Second Edition. Thieme. New York. 2008: 531-51.
- Berger MS, Ghatan S, Hagiund MM, Dobbins J, Ojeman GA. Lowgrade gliomas associated with intractable epilepsy: seizure outcome utilizing electrocorticography- during tumor resection. J Neurosurg 1993; 79: 62-9.
- Becker AJ, Wiestier OD, Figarella-Branger D, Blümcke I . Ganglioma and gangliocytoma. In: Louis DN, Ohgaki H, Wiestler OD, Cavence WK (eds): WHO Classification of Tumours of the Central Nervous System. International Agency for Research on Cancer. Lyon. WHO, 4th Edition, 2007: 103-5.
- Herrera EJ, Cáceres Ni, Viano JC, Costelio G. Suárez MS, Suárez JC. Stereotactic neurosurgery in children and adolescents. Child's Ner Syst 1999; 15: 256-61.
- Herrera EJ, Viano JC, Gómez JM, Surur A, Suárez JC. Interstitial stereotactic radiosurgery- of pilocytic astrocytomas in paediatric patients. Acta Neurochir (Wien) 2007; 149: 887-96.
- Awad IA, Robinson JR. Cavernous malformations and epilepsy. In: Awad JA, Barrow DL (eds): Cavernous Malformations. AANS. Publications Committee. Park Ridge, Illinois. 1993: 49-63.
- Spreafico R, Becker AJ. Pathology of malformations of cortical development. In Lüders HO ed Epilepsy Surgery. Informa Healthcare. London. 2008: 1349-58.
- Palmini A, Gambardella A, Andermann F, Deucau F, Da Costa JC, Olivier A et al. Intrinsic epileptogenity of human dysplastic cortex as suggestive by corticography and su rgical results. Ann Neurology 1995; 37: 476-87.
- Palmini A, Najm I, Avanzini G, Babb T, Guerrini R. Foldvary-Schaefer N, et al. Terminology and classification of the cortica' dysplasias. Neurology 2004; 62 (6 suppl 3): S2-8 Review.
- González-Martinez JA, Najm IM , Bingaman WE, Ruggieri P (2006). Epilepsy Surgery,' in Focal Malformations of Cortical Development (MCD). En: Wyllie E (ed): The Treatment of Epilepsy. Lippincott Williams & Wilkins. Philadelphia. Fourth Edition, 2006: 1103-10.
- Luders H, Lesser R, Dinner D. Chronic intracranial recording and stimulation with subdural electrodes. En: EngelJJ ed Surgical treatment of the epilepsies. New York, Rayen Press. 1987: 297-321.
- Palmini A, Gambardella A, Andermann F, Dubeau F, Da Costa JC, Olivier A. Operative strategies for patients with cortical dysplastic lesions and intractable epilepsy. Epilepsia 1994; 35: suppl 6: S57-S71.
- Russo G, Tassi L, Cossu M, Cardinale F, Mai R, Castaña L et al.. Focal cortical resection in malformations of cortical development- Epileptic Disord 2003; 5 (Suppl 2): S115-S123.
- Fertig EJ, Spencer SS. Hippocampal Sclerosis and Dual Pathology. In: Wyllie E (ed): The Treatment of Epilepsy. Lippincott Williams & Wilkins. Philadelphia. Fourth Edition, 2006: 1069-85.
- Diehl B, Najm I, Mohamed A. Babb T, Ying Z, Bingaman W. Interictal EEG, hippocampal atroph:v and cell densities in hippocampal sclerosis and hippocampal sclerosis associated with microscopic cortical dysplasia. J Clin Neurophysiol 2002; 19: 157-62.
- Pomata HB, Bartuluchi M, Cuello M, Vázquez C, Petre C, Libienicki F. Epilepsia refractaria del lóbulo temporal secundaria a patologia dual. Nuestra experiencia de 32 casos. Rey. Argent de Neurocir 2008; 22(2): 128-30.
- Daumas-Duport C, Scheithauer BW, Chodkiewicz JP, Laws ER Jr, Vedrenne C. Dysembrioplastic neuroepitelial tumor: a surgically curable tumour of young patients with intractable partial seizures. Neurosurgery 1988; 23: 545-56.
- Taratuto AL, Pomata H, Sevlever G, Gallo G, Monges J. Dysembrioplastic neuroepithelial tumor: morphological, inmunocytochemical, and deoxyribonucleic acid analysis in a periatric series. Neurosurgery 1995; 36: 474-81.
- Binder DK, Schramn J (2008) Resective surgical techniques: mesial temporal lobe epilepsy. In: Lüders HO ed Epilepsy Surgery. Informa Healthcare. London. Chapter 116, pp. 1083-92.
- Walker AE, Ercule F. Posttraumatic epilepsy 15 years laten Epilepsia 1970; 11: 17-26.
- Suárez JC, Bulacio JC, Armelini P, Sfaello ZM, Viano JC, Herrera EJ et al. Surgical treatment of late-onset post-traumatic pardal seizures in a child. Child's Ner Syst 2004; 20: 434-7.
- Langendorf F, Pedley TA (1998). Post-traumatic seizures. En: Engel J, Pedley TA (eds). Epilepsy. Lippincott-Raven. Philadelphia, 1998: 2469-74.
- Willmore LJ, Sypert GW, Munson JB. Recurrent seizures induced by cortical iron injection: a model of posttraumatic epilepsy. Ann Neurol 1978; 4: 329-36.
ABSTRACT
Objective: to present our 20 years of experience in surgery of lesional epilepsy in infants and adolescents.
Population and Method: retrospective study based on medical records of patients with epilepsy operated on betweert January 1990 and December 2009 in Sanatorio Allende and Hospital Infantil de Córdoba.
Results: 46 children un.der the age of 15 were included: 32 tumors (67.3%), 5 cavernomas, 2 cortical displeases, 2 mesial gliosis„ 1 mesial gliosis associated with dysplasia, I arteriovenous malforrnation, I Rasmüssen syndrome, 1 gliosis due to traumatic brain injury, 1 patients with encephalitis history. Localization was temporal in 20 cases (43.4%) and extra-temporal in 26 cases (56.5%). Between the mornent of the evolution into epilepsy and surgery, mean toas 31,1 months. From the 46 cases, 41 cases were surgically treateci, and 5 cases with Iodine-125 brachytherapy. There was no surgical rnortality.
Discussion: In terms of epilepsy, surgical treatment (including patients treated with conventional surgery and brachytherapy) was satisfactory. Currently, the 44 patients alive 43 are free from disabling crises, 22 patients are rnedication:free and 34 patients have a normal EEG.
Conclusion. In our series, patients with braintumors present a satisfactory control over conuulsive crises after tumor resection. Good results were also achieved in non-tumor pathologies
Key words: lesional epilepsy, children, tumors, dysplasia, cavernorna
COMENTARIO
El Prof. Julio Cesar Suárez y colaboradores presentan una detallada y prolija exposición de su experiencia durante 20 anos en cirugía de la epilepsia lesional en niños y adolescentes en dos prestigiosos Centros del país: Sanatorio Allende y Hospital Infantil de Córdoba.
Se realizó un estudio retrospectivo de las historias clínicas de 46 niños menores de 15 anos con epilepsia lesional, 12 de los cuales eran considerados refractarios. La edad media al comienzo de la epilepsia fue de 6 anos y medio, con un rango de 2 a 170 meses, lo que coincide con la literatura consultada. Los autores analizan detalladamente la frecuencia de las crisis según las distintas etiologías y los diferentes tipo de crisis epilépticas, como así también la localización topográfica de las lesiones. Una interesante observación es que los 16 pacientes operados antes del año 2000 presentaron una duración media de la epilepsia previa a la cirugía de 34 meses contra una media de 29 meses en los 30 pacientes operados después de esa fecha. Como bien sugieren los autores, esto se debió probablemente "a un diagnóstico más temprano gracias a las nuevas técnicas de imagen y a una mayor concientización de los beneficios de la cirugía" principalmente entre los neurólogos infantiles y pediatras, tan reticentes al comienzo.
Cuando los autores describen los estudios neurofisiológicos realizados antes de la cirugía, expresan que se realizó video-EEG en 7 de los 46 casos. Si bien mencionan en cuales casos se aplicó, no aclaran el criterio que se utilizó para realizarlos en estos 7 casos en particular y no en otros. También llama la atención el poco uso de la electrocorticografía intraopratoria (4 casos de los cuales 3 fueron reintervenciones por recidiva tumoral), sobre todo en los 26 casos de epilepsia extratemporal, pues, como bien dicen los autores" ...estos estudios permiten identificar adecuadamente el área epileptogénica que no siempre coincide en su totalidad con el área lesional". Un ejemplo típico de ello es el cavernoma, donde la epilepsia no cura al resecar la lesión, sino que es necesario también resecar el área hemosiderótica que la rodea.
De los 64 casos analizados, 32 resultaron tumores: 25 gliales y 7 neurogliales. En la serie de tumores neurogliales del Hospital Nacional de Pediatria "Prof Juan P. Garrahan" hemos observado que las crisis cedieron aunque la resección tumoral no fue completa como algunas veces ocurre, dada la similitud de estos tumores con el parénquima normal y, en esos casos, es dificil determinar el limite entre ambos. Sin embargo, cuando en estos casos las crisis reaparecieron, siempre coincidieron con crecimiento del tumor residual, y allí es mandatoria la resección total, como los autores realizaron en 3 de sus casos.
De los 46 casos, 41 fueron tratados con cirugía y 5 con braquiterapia. Cabe destacar que estos autores tienen el mérito de ser pioneros en el país en el tratamiento de la epilepsia lesional en niños con braquiterapia. Lamentablemente no aclaran en esta presentación cuál fue el criterio que se aplicó para decidir en 5 casos dicho tratamiento y cuál fue la técnica radioquirúrgica empleada.
La conclusión: "la epilepsia lesional tumoral, como la epilepsia lesional refractaria, deben ser operadas precozmente para evitar los efectos neuronales deletéreos de las crisis y los efectos neurotóxicos de los anticonvulsivantes", si bien no es válida como tal, dado que no surge de los resultados (en ningún lugar del texto se comparan resultados de dos grupos, los operados precozmente de los operados tardíamente), es un excelente consejo para la desconfiada visión de muchos neurólogos para la cirugía de la epilepsia.
Los autores definen discretamente sus resultados como "buenos desde el punto de vista de la epilepsia". A nuestro entender, que de 12 pacientes con epilepsia refractaria, 9 tengan Engel IA y 2 Engel IB ; y que de 44 ninos vivos, 1 solo presenta crisis convulsivas discapacitantes y 20 no reciben medicación, son resultados excelentes.
Cabe destacar, que el Equipo de Epilepsia Infantil, liderado por el Prof. Julio César Suárez es el más importante del interior del país, y un ejemplo de vida. Una vida íntegramente dedicada al estudio y tratamiento de la patología neuroquirúrgica de la infancia, como ha llevado el Prof. Suárez, pone en evidencia que él es un fiel y digno representante de la Escuela del Prof Raúl Carrea, no sólo como cirujano sino también como formador de generaciones de neurocirujanos infantiles.
Graciela Zúccaro
