Título
Selección del candidato y tratamiento quirúrgico
Autor
Fecha
Texto
Epilepsia extratemporal
Selección del candidato y tratamiento quirúrgico
Hugo B. Pomata
Servicio de Neurocirugía. Hospital Nacional de Pediatría "Prof. Dr. Juan P. Garrahan"
RESUMEN
Se analizan los resultados obtenidos en 60 niños y 8 adultos con diagnóstico de epilepsia extratemporal operados entre 1988 y 1998 con un seguimiento mayor de 2 años. Todos fueron estudiados con TAC e IRM y EEG de cuero cabelludo. La Videotelemetría, ECoG intraoperatoria y la PESS se utilizaron de acuerdo con las necesidades de cada caso. En los niños se efectuaron 24 lesionectomías, 25 desconexiones, 7 polectomías y / o lobectomías, 1 hemisferectomía y 3 corticectomías. En los adultos se efectuaron 1 lobectomía, 4 corticectomías y 3 lesionectomías. De acuerdo con los criterios de Engel, en los niños los resultados fueron: 40 clase I, 5 clase II y 4 clase IV. En los adultos los resultados fueron: 4 clase I, 2 clase II, 1 clase III y 1 clase IV. Se excluyeron 11 pacientes con callostomías por no poder aplicar los criterios de Engel.
Palabras clave: epilepsia extratemporal, cirugía.
ABSTRACT
We analyzed the outcome in 60 children and 8 adults with extratemporal epilepsy operated between 1988-1998 and a follow-up of more than 2 years. AU patients were studied with CAT, MRI and scalp EEG. Video-telemetry, intraoperative ECoG and SSEP were used according to the needs of each case. In children were performed 24 lesionectomies, 25 disconnections, 7 polectomies and/ Or lobectomies, 1 hemispherectomy and 3 corticectomies. In the adults we performed 1 lobectomy, 4 corticectomies and 3 lesionectomies. According with Engercriteria, the surgical results in children were: 40 class I, 5 class II and 4 class N. In the adults the surgical results were: 4 class I, 2 class II, 1 class III and 1 class IV We excluded 11 patients with callostomies because Engel'criteria could not be applied.
Key words: extratemporal epilepsy, surgen d.
INTRODUCCIÓN
La cirugía de la epilepsia comienza a fines del siglo XIX cuando Sir V. Horxley opera exitosamente un grupo de pacientes que padecía epilepsias extratemporales postraumáticas. A mediados de los años '50, Penfield en Montreal y Tailarach en París llevan esta práctica quirúrgica a su expresión moderna con el desarrollo de mapas de funciones del cerebro humano obtenidos a través de la estimulación córtical. Al mismo tiempo Falconer en Londres, comenzó a efectuar las primeras lobectomías temporales "en block". La frecuencia de la epilepsia extratemporal (EE) en pediatría, generalmente sintomática, es mayor que la de la epilepsia temporal (ET). En especial si la comparamos con la población adulta19-3.
El rol de la neurofisiología intraoperatoria es mayor que en la cirugía del lóbulo temporal?, debiéndose remarcar la importancia de la ECoG y el PESS intraoperatorios, especialmente cuando el paciente no es operado despierto.
La llamada epilepsia catastrófica de la infancia, presente en la hemimegalencefalia, el Sturge Weber, las esclerosis tuberosas, las displasias y las heterotopías corticales, el síndrome de West, etc., encierra en su denominación la urgencia con que debe plantearse su tratamiento quirúrgico, para reducir a la mínima expresión el deterioro neurológico que los acompaña?.
Creemos indispensable puntualizar que la cirugía de la epilepsia no debe ser considerada como la última y frecuentemente postergada opción terapéutica para las epilepsias refractarias. Es indispensable aprovechar la llamada plasticidad cerebral, la capacidad del cerebro inmaduro de recuperarse de las agresiones que pueda sufrir. Recordemos que el pico máximo de sinaptogénesis, como sinónimo de maduración cerebral, se produce alrededor de los 7 años de edad15,16.
En pacientes con epilepsias neocorticales refractarias en quienes no se puede determinar la existencia de una lesión de las enuroimágenes, es necesario profundizar su estudio neurofisiológico, funcional y neuropsicológico para determinar la existencia de un área epileptogénica primaria, y proceder a su exéresis y/o desconexión.
MATERIAL Y MÉTODO
Entre junio de 1988 y abril de 2000 fueron operados por epilepsia refractaria 178 pacientes; de éllos 75 niños y 14 adultos padecían epilepsias extratemporales (EE). Se incluyen pacientes operados hasta junio de 1998, con un seguimiento no menor de 2 años. Se excluyen los pacientes a quienes se realizó callosotomía, con diagnóstico de síndrome de Lennox-Gastaud. La indicación de la cirugía en estos pacientes fue con criterio paliativo y dirigida especialmente al control de las caídas que padecían. En ellos no pueden aplicarse los criterios de Engel. (Tablas 1, 2 y 3).
Cuadro clínico
Predominaron los siguientes tipos de crisis, de acuerdo a la localización del foco epileptogénico primario:
Lóbulo frontal: tónicas asimétricas, hipermotoras, oculocefálicas, ausencias sintomáticas.
Lóbulo parietal: sensoriales + signos de propagación. Area central: clónicas focales contralaterales. Lóbulo occipital: alucinaciones visuales simples y/o complejas. Hipotálamo: crisis gelásticas. Difusas: drop-attacks, epilepsia partialis continua . Otras: status epilepticus.
Estudios
Todos los pacientes fueron estudiados con TAC, RM y EEG de scalp. Desde 1997 todas las IRM incluyen cortes finos, los axiales siguiendo el eje mayor del hipocampo, con FLAIR e Inversión/ Recuperación (protocolo para epilepsias). En algunos pacientes también se efectuó IRM espectroscópica desde 1998. (Tabla 4).
Los exámenes neurológicos realizados se resumen en la tabla 5 y la localización de las lesiones en la tabla 6.
Tabla 1. Población
Tabla 2. Etiología
| Niños | Adultos | |
| 60 | 8 | |
| Encefalitis de Rasmussen | 7 | |
| DNTs | 6 | |
| Displasias corticales | 5 | |
| Esclerosis tuberosa | 4 | |
| Quiste porencefálico | 4 | 1 |
| Gliomas de bajo grado | 3 | 1 |
| Angioma cavernoso | 2 | 1 |
| Gliosis | 2 | |
| No lesional | 1 | |
| Sin patología* | 17 | 1 |
Tabla 3. Tiempo de evolución de epilepsia
Tabla 4. Imágenes
Tabla 5. Exámenes neurofisiológicos
Tabla 6. Localización
La tabla 7 da cuenta de los procedimientos quirúrgicos realizados y la tabla 8 resume los estudios neurofisiológicos intraoperatorios en los diversos procedimientos
Tabla 7. Procedimientos quirúrgicos
| Niños | Adultos | |
| 60 | 8 | |
| Lesionectomías | 24 | 3 |
| Desconexiones: | ||
| Callosotomías | 11 | |
| Hemisferectomías | ||
| Funcionales | 4 | |
| Hemisferotomías | 3 | |
| Lobares/ multilobares | 4 | |
| (+ TSM =3) | ||
| TSM (único procedimiento) | 2 | |
| Polectomías / lobectomías/ | ||
| hemisferectomía anatómica | 9 | |
| Corticectomías | 3 | 4 |
Tabla 8. Estudios neurofisiológicos intra-op
RESULTADOS
Se aplica la clasificación de J. Engel (ver anexo), en 49/60 niños y 8 adultos. Tablas 9 y 10.
Tabla 9. Clasificación de Enge
Tabla 10. Complicaciones y secuelas
| Niños (60) | Adultos (8) | |
| Hemiparesias 4 (6,66%) Hidrocefalia | 1• | |
| definitivas | 2 (3,33%) Hematoma | |
| transitorias 2 (3,33%) intraparenquimatoso 1# | ||
| Alteraciones | ||
| campimétricas 4 (44,4%) | ||
| (procedimientos efectuados en el lóbulo occipital y / temporal posterior) | ||
| Hematoma | ||
| extradural | 1 (1,6%) | |
| Edema localizado 1 (1,6%) | ||
| * compensada | ||
| # postimplantación de electrodos subdurales | ||
DISCUSIÓN
En un período de 12 años -1988-2000- fueron operados 178 pacientes por epilepsia refractaria (60 niños y 8 adultos), con un seguimiento postoperatorio mayor de 2 años. La edad media de los niños fue de 6 años, la de los adultos 30. La evolución media de las epilepsias hasta su tratamiento quirúrgico fue de 6 años en los niños y 10 en los adultos. Hubo un alto porcentaje de epilepsias sintomáticas (95,6%), acorde con lo comunicado por otros centros. Solamente 4/68 (5,8%) pacientes tuvieron epilepsias idiopáticas (criptogenéticas). De los 60 niños, 50 padecían epilepsias sintomáticas antes de los 10 años de edad, época a partir de la cual se puede considerar terminada la sinaptogénesis cerebral. Dilatar su tratamiento quirúrgico pudo haber llevado a que se perdiera la plasticidad neuronal y la posibilidad de recuperar funciones perdidas por la enfermedad misma o por eventuales déficits que pudieran agregar las cirugías a las que debieron ser sometidos8. En el 62,5% de los adultos las epilepsias comenzaron en edad temprana. Sin embargo, el desarrollo neurológico e intelectual fue normal. También la población adulta se benefició con la oportuna indicación de la cirugía. Mediante la IRM de alto campo desde 1997 se define el llamado protocolo para epilepsia que incluye cortes corona-les en FLAIR e I/R y cortes axiales a lo largo del eje mayor del hipocampo, especialmente útil en las epilepsias temporales. Mediante la IRM espectroscópica se efectuaron estudios volumétricos de los hipocampos. La IRM de alto campo en su modalidad de I/R fue fundamental para mejorar el diagnóstico preoperatorio de las epilepsias, incorporando a los diagnósticos diferenciales la llamada patología dual responsable del fracaso de cierto número de procedimientos quirúrgicos20-26.
Se debe puntualizar que la llamada "revolución de la imagen", equiparable a la que produjo la EEG en la década del '30, significó un cambio sustancial en el estudio del paciente epiléptico refractario. No cabe duda que en el momento actual podemos diferenciar entre los candidatos a cirugía de la epilepsia 2 grupos5, a saber: a) con lesión demostrable en la IRM; b) sin lesión visible aún utilizando el protocolo para epilepsia. Este último grupo es un verdadero desafio para el equipo de cirugía de la epilepsia. En ellos las posibilidades de éxito son menores que en los pacientes del primer grupos.
La moderna neuroimagen unida a la Video-telemetría redujo en forma sustancial la utilización, en la etapa diagnóstica, de electrodos semiinvasivos (foramen oval, PEG) e intracraneanos (subdurales o profundos).
Es importante remarcar el aporte que significó el advenimiento de las nuevas técnicas electroencefalográficas en la selección del candidato a cirugía. Hacia fines de 1995 y comienzo del '96 se inauguraron en el país las primeras unidades de Video-telemetría, lo que mejoró y enriqueció el estudio de los candidatos. Esto permitió llegar a la cirugía con información suficiente para reducir el porcentaje de decisiones intraoperatorias, que dependían de la ECoG, con un potencial margen de error derivado del factor anestésico. La videotelemetría se efectuó en 47/68 (69,1%) de los pacientes. Los 21 pacientes operados sin Video-telemetría prequirúrgica tenían lesiones extensas con buen correlato con la clínica y el EEG prolongado computarizado (Fig. 1).
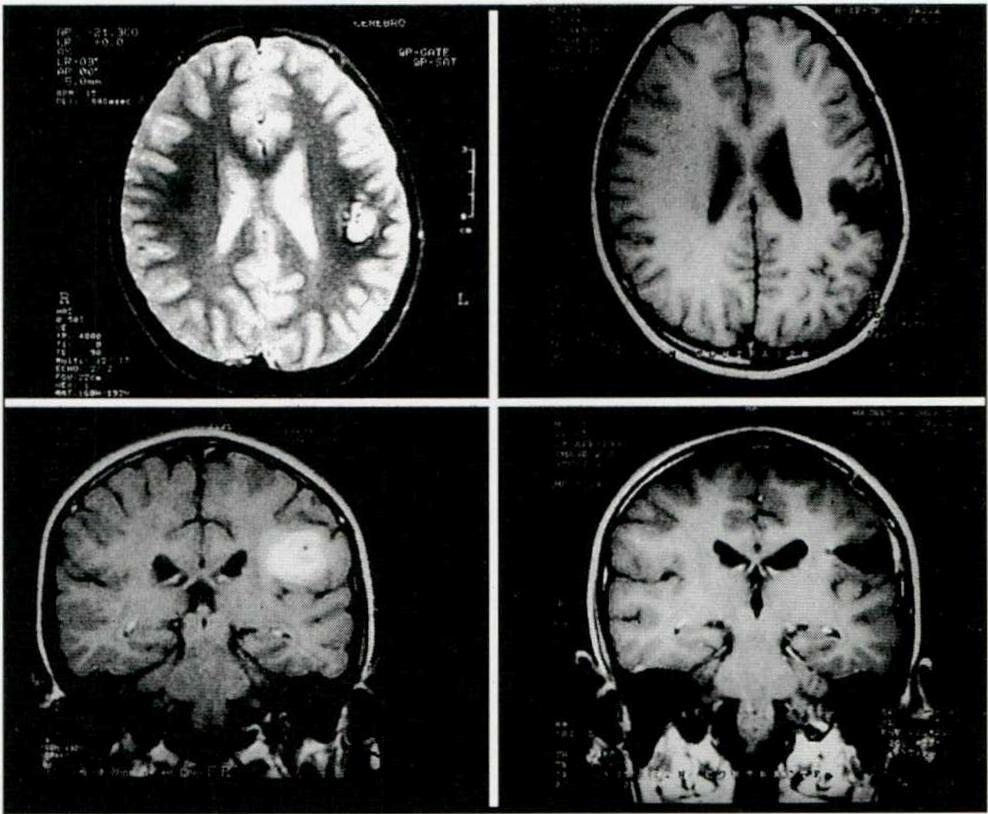
Fig. 1. Paciente varón de 9 años de edad, con crisis convulsivas mensuales. Los cortes axiales y coronales pre y postoperatorios de la IRM muestran un cavernoma del área central y su resección. Cuatro años de evolución postoperatoria sin crisis y sin secuelas
A 7/8 adultos se les efectuó videotelemetría. El restante había sido operado 5 meses antes de un glioma frontal grado II.
Las epilepsias frontales son las que requirieron más estudios diagnósticos, ya sea por la dificultad en identificar la ZEP dentro del mismo lóbulo o para diferenciarlas de las epilepsias temporales21. Se implantaron electrodos subdurales en 14/68 pacientes porque subsistieron las siguientes dudas:
- si las epilepsias frontales eran propagadas de áreas epileptogénicas primarias que asentaban en el lóbulo temporal homolateral;
- si las epilepsias occipitales eran propagación de epilepsias temporales homolaterales;
- en las epilepsias frontales, qué parte de este extenso lóbulo (40% del hemisferio) era el origen del evento epiléptico que se analizaba.
La propagación hacia el lóbulo frontal u occipital homolateral de una crisis convulsiva originada en el lóbulo temporal podría no ser diagnosticada. En esta circunstancia la colocación de electrodos subdurales utilizados en 10 pacientes con epilepsia del lóbulo frontal siempre detectó la ZEP.
Fueron más excepcionales las dudas de lateralidad respecto al origen de la crisis epiléptica.
En algunos casos se utilizaron PEG2 o tiras de electrodos epi o subdurales. En todos los casos se confirmó la lateralidad presupuesta (Fig 2).
En los 19 casos de epilepsias multilobares así como en el hamartoma hipotalámico (crisis gelásticas) hubo un adecuado correlato entre la clínica, la imagen, la videotelemetría y/o el trazado EEG computarizado. Excepto el hamartoma hipotalámico, todos fueron operados en un sólo tiempo, con guía ECoG.
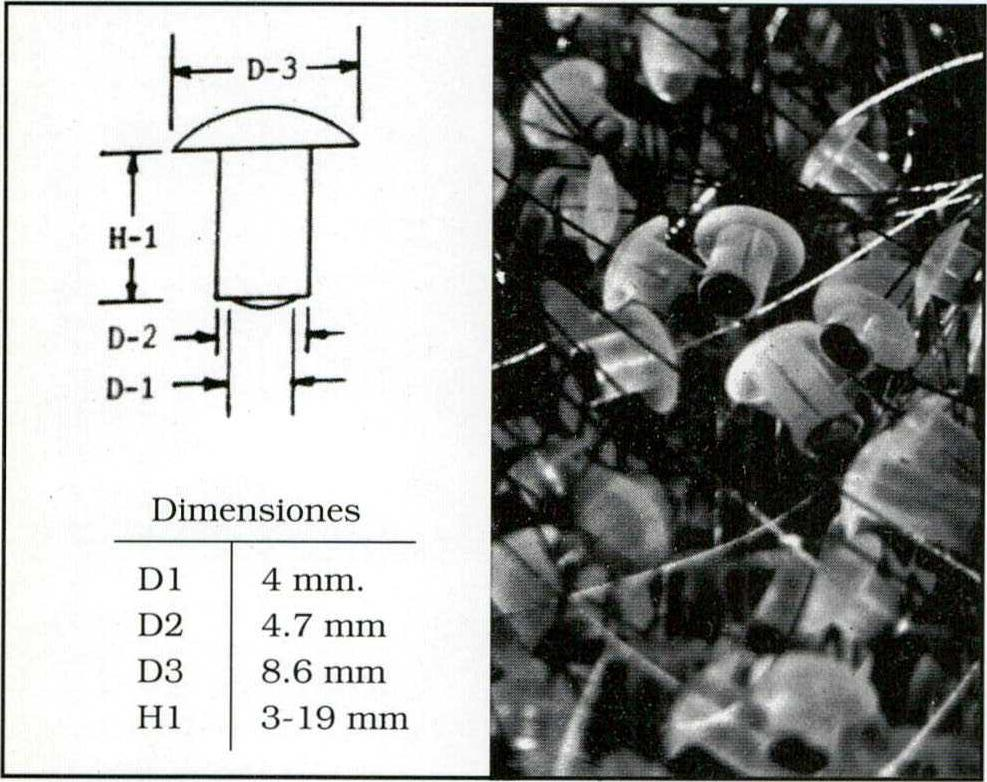
Fig. 2. Los PEG son "tapones" o tornillos uno de cuyos extremos (contactos) se apoya en la duramadre
En la población pediátrica 19/60 pacientes padecieron epilepsias multilobares, considerando como tales las que involucran 2 o más lóbulos.
En 11/60 pacientes estudiados con videotelemetría fue necesario recurrir a la utilización de electrodos intracraneanos9. Esto implicó efectuar cirugías en dos tiempos: uno inicial para la colocación de los electrodos y el traslado del paciente a la unidad de Video-telemetría; luego de captar un número suficiente de crisis, no menos de 3 a 5, se realizó segundo tiempo quirúrgico acorde a la estrategia definida previamente. (Figs. 3 y 4).
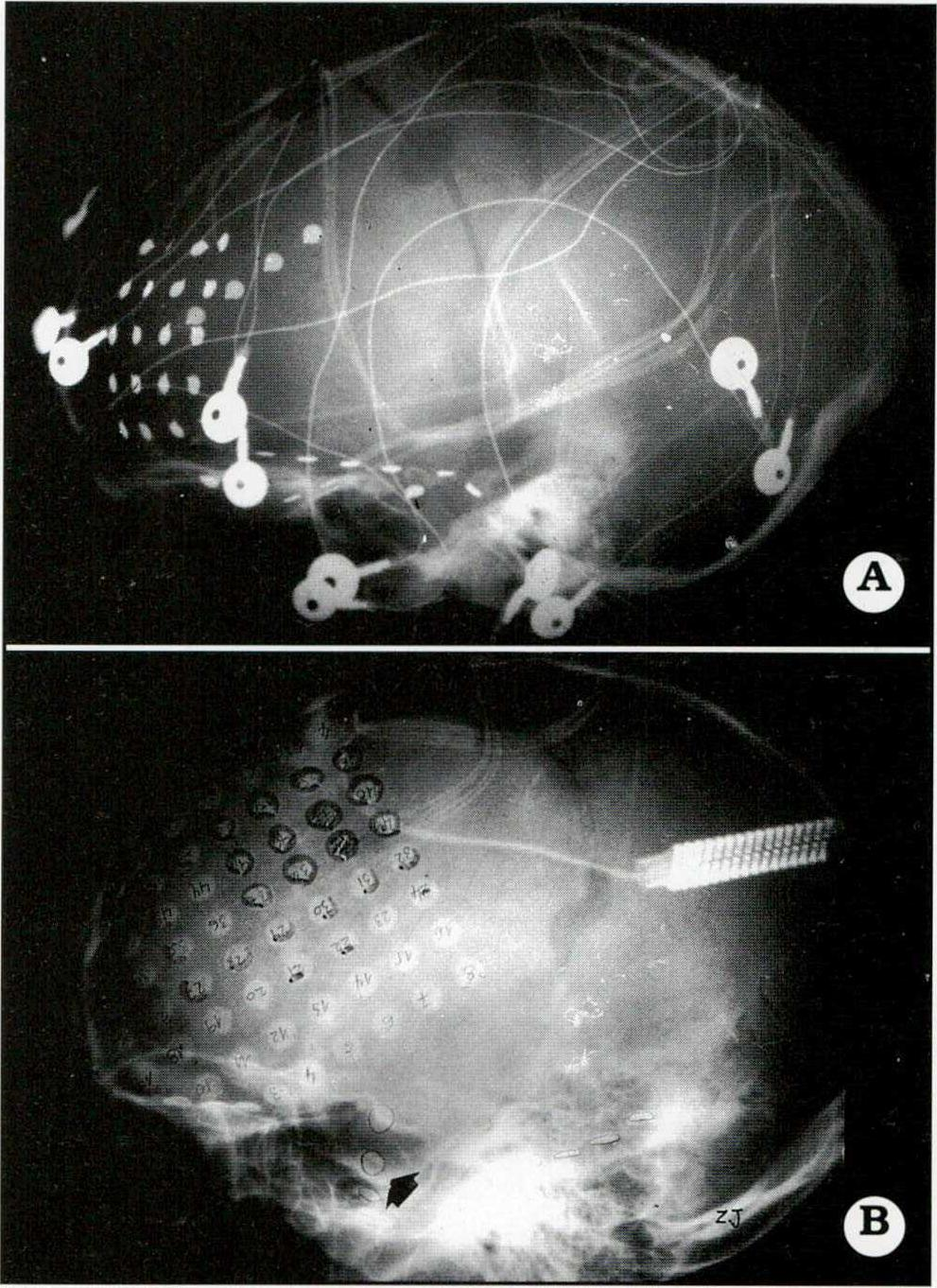
Fig. 3. A. Paciente de 9 años de edad con crisis frontales. Se implantaron una plaqueta con 20 electrodos cubriendo el lóbulo frontal izquierdo y 2 tiras, de 4 electrodos cada una, subtemporal polar y mesial. Se definió así el origen frontal de la epilepsia. B. Paciente de 11 años de edad con una extensa atrofia parietotemporal. Se implantó una plaqueta de 64 electrodos cubriendo ampliamente el lóbulo frontal y 1 tira de 4 electrodos subtemporal (flecha). En la unidad de videotelemetría no sólo se registraron crisis que ubicaron la ZEP (marcados con círculos y semicírculos), sino que también mediante estimulación cortical y PESS del nervio mediano se localizó el área motora primaria de la mano (electrodos sombreados). Esto determinó el límite posterior de la corticectomía efectuada.

Fig . 4. A. IRM preoperatoria que muestra una lesión occipital, hiperintensa en T I (estrella). B. Colocación de 2 plaquetas de 20 electrodos subdurales parietooccipitales. C. Esquema intraoperatorio, orientador para el trabajo del equipo de neurofisiología, durante la videotelemetría con los electrodos implantados. D. TAC con ventana ósea. Muestra la ubicación de los electrodos parieto-occipitales y en la base del lóbulo temporal (a la derecha, flecha). E. Polectomía occipital derecha. F. IRM postoperatoria.
En cuanto a los procedimientos quirúrgicos18, las lesionectomías (27/68) se utilizaron en aquellos casos en los que diferentes tipos de lesiones tenían algún grado de relación con la ZEP. Se hicieron bajo guía ECoG. Las estrategias de resección fueron: lesionectomías puras, con margen o ampliadas a áreas epileptogénicas alejadas de la lesión.
El sustento para la selección de cada procedimiento lo dio la ECoG, el tipo de lesión, su extensión y la relación con el área central y del lenguaje, zonas en las que obviamente las resecciones fueron más económicas (Fig 5).
Los procedimientos de desconexión fueron utilizados en 25/60 niños. Las bases racionales de su indicación fueron:
- Desconexiones lobares: pacientes con lesiones extensas con compromiso de uno o más lóbulos, o cuando la exéresis de las lesiones hubieran dejado grandes cavidades.
- Hemisferectomías funcionales- hemisferotomías 17: en pacientes con enfermedades evolutivas no neoplásicas, v.g. encefalitis de Rasmussen.
- TSM: para aislar focos epileptogénicos que se asentaban en áreas cerebrales elocuentes, v.g. zonas perirrolándica, de Wernicke o Brocca12. 13.
En las hemisferectomías funcionales no se efectuó la resección del lóbulo temporal, sino su desconexión mediante una callosotomía completa. Esto implica, por delante la sección del pico con lo que se logra la desconecxión de la comisura blanca anterior y por detrás la sección del rodete, tratando de incluir la comisura hipocampal posterior. Completada la misma, siguiendo el plexo coroideo en su entrada a la prolongación esfenoidal del ventrículo lateral, se desconecta el fórnix. Esta maniobra permite, una vez finalizada, ver la cisterna cuadrigeminal. Se completa la desconexión del lóbulo temporal seccionando su neocorteza. Esta variante de la hemisferectomía funcional clásica (propuesta por Rasmussen, desconexión en vez de exéresis del lóbulo temporal), es un aporte del autor del que no se halla referencia en la literatura24.
En esta serie se efectuó una única hemisferectomía anatómica en una niña de 10 meses de edad que padecía una epilepsia catastrófica secundaria a una hemimegaloencefalia (Fig. 6).
Las polectomías y/o lobectomías fueron efectuadas en 8/68 pacientes. El límite posterior de las lobectomías frontales fue el surco precentral. El lateral, 1,5 a 2 cm de la pars opercularis y triangularis del lóbulo frontal, el medial 0,5 a 1 cm de la línea media tratando de respetar la circonvolución supracallosa y la del cíngulo, siempre que no asentara en ellas el área epileptogénica primaria. El limite basal (área frontoorbitaria) lo da la sección del girus recto14. Las resecciones occipitales se efectuaron en pacientes con hemianopsias previas14. La resección del área central y lóbulo parietal efectuada en los niños de hasta 7 años de edad no agregó déficits neurológicos.

Fig. 5A. IRM, displasia del área parieto-central derecha (paciente varón, 10 años, con 6 años de evolución de epilepsia y hemiparesia congénita). Bajo guía ECoG se efectuó una lesionectomía ampliarla No se resecó la parte de la lesión superpuesta al área sensorial primaria del cerebro. Actualmente se encuentra en clase ID de Engel. B. La pieza resecada. C. TAC de control postoperatorio inmediato

Fig. 6. A. Hemisferectomía anatómica. Pieza quirúrgica. Paciente con hemimegaloencefalia. B. Lodge quirúrgica. La IRM preoperatoria y la TAC postoperatoria pueden verse en la parte I de este trabajo. (Rey. Argent. de Neurocirugía.1999.
Fueron procedimientos efectuados bajo guía ECoG y con frecuencia complementados con TSM14. Se efectuó corticectomía en 7/68 pacientes. Las corticectomías del lóbulo frontal, respetando parámetros anatómicos, deben ser lo más extensas posible. Las perirrolándicas deben preservar el área correspondiente a la mano y al pie (Fig 7).
El subgrupo de pacientes que padeció epilepsias secuelares a radioterapia planteó problemas particulares (4/60). Esta situación se dio sólo en la población pediátrica. En éllos la apertura del plano dural agregó al daño ocasionado por la radioterapia, el inherente a las maniobras quirúrgicas necesarias para despegar la duramadre. Sin embargo, 3/4 experimentaron marcada mejoría de sus epilepsias después de los procedimientos resectivos. Dos de los 4 pacientes debieron ser reoperados para mejorar el control de sus crisis.

Fig. 7. Corticectomía parietal en una paciente del6 años de edad, con 30-60 crisis / día, secundaria a displasia cortical parietal.
En cuanto a la evaluación intraoperatoria, la ECoG tuvo un rol importante en los procedimientos resectivos (26/35) y en menor medida en los de desconexión. En este subgrupo fue útil para las desconexiones lobares (6/25). No se utilizó en las hemisferectomías, hemisferotomías ni en las callosotomías.10. Los PESS se usaron en las epilepsias del área central (4/35) para determinar con certeza las áreas sensoriales y motoras primarias del cerebro.
En 4/11 callosotomías, el EEG de scalp con electrodos colocados en el hemicráneo contralateral al abordaje, se utilizó como guía para fijar el límite posterior de la sección del cuerpo calloso. El indicador de finalización del procedimiento fue el cambio de patrón del trazado eléctrico con el que se había comenzado la sección. En nuestra experiencia este método indujo a una sección más reducida del cuerpo calloso que las que se obtienen cuando se efectúan bajo pautas anatómicas1. En la acualidad, la neuronavegación es una posibilidad técnica de indudable utilidad para conocer la extensión real de la callosotomía durante la cirugía.
El tipo de anestesia utilizado es determinante para obtener adecuados registros neurofisiológicos intraoperatorios. Debe ponerse especial énfasis en el control de la tensión arterial dado que los potenciales desaparecen con registros de tensión inferiores a 50- 60 mm Hg . Ante la ausencia de un foco eléctrico claro en el registro, pueden darse pequeñas dosis de barbitúricos de corta duración que actúan como estimulantes corticales.
Las complicaciones pueden clasificarse en no deseadas, no esperadas, infrecuentes y potencialmente evitables4 Los procedimientos resectivos del cerebro con frecuencia pueden producir o incrementar déficits neurológicos preexisentes25. Se presentaron 4/68 hemiparesias, 2 transitorias y 2 definitivas. Una de éstas en un paciente con un ganglioglioma frontotemporal cuya exéresis provocó un espasmo del segmento P2 de la cerebral posterior y otra en el paciente con el hamartoma hipotalámico en quien la cirugía provocó una hemiparesia como consecuencia de una lesión del tronco cerebral. Pese a la reducción del 70% de las crisis gelásticas, consideramos inaceptable esta eventualidad. La conducta que hemos fijado respecto a esta entidad es que salvo las lesiones pediculadas que "flotan" en la cisterna prepontina, los otros casos no deben ser operados con cirugía convencional quedando la posibilidad del tratamiento radioquirúrgico22.
Las 4 alteraciones campimétricas fueron déficits preexistentes y secuelas previsibles en la sepilepsias con foco occipital y/o temporal posterior. Creemos que la buena evolución postoperatoria de los pacientes justifica esta secuela para superar o mejorar la enfermedad. Un hematoma extradural fue producto de la implantación de electrodos epidurales y fue evacuado sin secuelas25.
En un paciente adulto, la colocación de electrodos subdurales provocó un hematoma subdural e intraprenquimatoso sintomático. Fue necesario retirar los electrodos subdurales y la evacuación simultánea del hematoma, sin secuelas.
Un niño operado en status epilepticus, con permanencia en ARM durante los 62 días previos a la cirugía, presentó un edema localizado. Se operó con diagnóstico de epilepsia del área central. Se le efectuó una TSM y, luego bajo guía ECoG, se desconectó el lóbulo frontal derecho 11. A las 24 horas se realizó un desplaquetamiento, por un importante edema de la zona quirúrgica que desplazaba la línea media. A los 15 días se retiró la ARM. En el momento actual presenta una mejoría significativa de sus crisis, y un deterioro neurológico grave como secuela del status epilepticus.
Con respecto a los resultados, se clasifican 57/68 pacientes. Se excluyen los pacientes a quienes se efectuó callosotomías ya que la indicación de la cirugía en estos pacientes, portadores de síndrome de Lennox-Gastaud, fue paliativa. Se puede observar que entre las clases I y II hay 51/57 (89,4%) de los pacientes, lo que implica un muy buen resultado. Si incluimos la clase III se reúnen 52/57 (91,22%) lo que reafirma la utilidad y estimula el desarrollo de esta posibilidad terapéutica.
CONCLUSIONES
- Es universalmente aceptado que la morbimortalidad de los pacientes que padecen epilepsias refractarias, es mayor con un tratamiento médico prolongado e inefectivo, que el que potencialmente puede provocar su tratamiento quirúrgico.
- Si bien los pacientes con E.E. tienen una expectativa de curación inferior a la E.T., los resultados obtenidos, justifican la aplicación de esta modalidad terapéutica.
- El alto grado de organicidad (epilepsia sintomática) de esta serie torna injustificable el tiempo de latencia entre el comienzo de la enfermedad y su tratamiento quirúrgico.
- Las complicaciones y secuelas observadas son las esperablesdado el tipo y localización de las lesiones epileptogénicas.
- Consideramos que la cirugía de la E.E. está injustificadamente subutilizada como posibilidad terapéutica en nuestro medio.
BIBLIOGRAFÍA
- Awad IA, Wyllie E, Lüders HO, Hal J. Intraoperative determination of corpus callosotomy for epilepsy: two simple techniques. Neurosurgery 26: 102106, 1990.
- Barnett GH, Burgess R, Awad IA, Skipper GJ, Edwards CR, Lüders HO. Epidural PEG electrodes for presurgical evaluation of intractable epilepsy. Neurosurgery 27: 113-115, 1990.
- Cahan LD, Sutherling W, Mc Coullogh AM, Rausch R, Engel J, Crandall PH, Review of 20 years UCLA experience with surgery for epilepsy. Cleve Clin Q 51: 313-318, 1984.
- Cataltepe O, Comair Y. Complications of extratemporal epilepsy surgery in infants and children. En: Pediatric epilepsy syndrome and their surgical treatment. Cap 72 pág. 709-725. Editor: I. Tuxhorn- H. Holthausen- H. Boenigk. John Libbey. London. England. 1997.
- Comair Y, Choi HY, Van Ness P. Neocortical resections. In Epilepsy- A comprehensive textbook. Vol 2. Cap 171 pág. 1820. Editor: J. Engel (Jr). Timothy A. Padley. Lippincott-Raven Presss. 1998.
- Comair Y, Choi HY, Van Ness P. Neocortical resections. In Epilepsy- A comprehensive textbook. Vol. 2. Cap. 171 pág. 1.825. Editor J. Engel (Jr). Timothy A. Padley- Lippincott- Rayen Press. 1998.
- Jean-Pierre Farmer. Operative strategies in the management of extratemporal epilepsy of childhood. Chap 70 pág. 691-695. En: Paediatric Epilepsy Syndromes and their Surgical Treatment. I. Editors Tuxhorn, H. Holthausen, H. Boenigk. Published by John Libbey Company Ltd. London. England. 1997.
- Farmer SF, Harrison LM, Stevens JA. Plasticity of central motor pathways in children with hemiplegic cerebral palsy. Neurology 41: 1.505-1.510, 1991.
- R. García de Sola. Exploración del paciente epiléptico con electrodos intracraneales. Cap. 15. En: Tratamiento de la epilepsias. Editor Francisco Villarejo. Díaz Santos. Madrid. 1998.
- García MC, Tenca E, Pomata HB, Stelles S, Cervio A, D'Gianno C, Rabinowicz A. Utilidad de la electrocorticografia para definir área epilpetogénica en pacientes epilépticos sometidos a cirugía. 'Crisis 4: 5-12, 1998.
- Gorman D, Shields D, Sherwalon A, Chugani H, Finker R, Comair Y, Peackock W. Neurosurgical treatment of refractory status epilepticus. Epilepsia 33: 516-519, 1992.
- Kaufmann W, Krauss GL, Vematsu S, Lesser R. Treatment of epilepsy with multiple subpial transections: an acute histologic analysis in human subjects. Epilepsia 37: 342-352, 1996.
- Morrell F, Whisser WW, Bleck TP, Multiple subpial transection: a new approach to the surgical treatment of focal epilepsy. J. Neurosurgery 70: 231239, 1989.
- André Olivier M.D., Ph. D. FRCS (C) Surgery of Epilepsy. Oyeran procedure. Pág. 38-43. Montreal Neurological Hospital and Institute. Mc Gill University. Montreal. Quebec. Canadá. 1995.
- Peacock WJ, Comair Y, Chugani HT, Shewmon DA, Shields WD. Epilepsy surgery in childhood Chap 66. Pag. 589-598. En: Epilespy Surgery . Editor J. Engel (Jr) 2a.. ed. Rayen Press. N.Y. 1992.
- Peacock WJ, Comair Y, Hoffman H, Montes JL, Morrison G. Special considerations for epilepsy surgery in childhood. Cap 46pág. 541-547. En: Surgical Treatment of epilepsies. Editor J. Engel (Jr) 2a. ed.Raven Press. N.Y. 1993.
- Pomata H, Delalande O, González R, Monges J. Hemisferotomía como tratamiento de la encefalitis de Rasmusen. Rev Argent de Neuroc 9: 153-159, 1995.
- Pomata H, Waisburg H, Medina C. Epilepsias extratemporales. Cap. 17 pág. 295-320. En: Tratamiento de la Epilepsia. Editor Francisco Villarejo Ortega. Editorial Díaz de Santos. Madrid. 1998.
- Prats AR, Morrison G, Wolf A. Focal cortical resections for the treatment of extratemporal epilepsy in children. Neurosurgery Clin North Am 6: 533534, 1995.
- Sisodiya SM, Moran N, Free SL, Kitchen ND, Stevens JM, Harkness WFJ, Fish DR, Shervo Sd. Correlation of widespread preoperative magnetic resonance Imaging changes with unsuccessful surgery for hippocampal sclerosis. Ann Neurol 41: 490-496, 1997.
- Stephan H, Quesney LF, Feister HK, Schüler P, Wies m, Hurnmer C. Pauli E. Presurgical evaluation in frontal lobe epilepsy. A multimethodological approach. Cap 15. En: Epilepsy and the functional anatomy of the frontal lobe. Editors: Jasper H. H., Riggio S. and Goldmanrakic P.S. Rayen Press Ltd. N.Y. 1995.
- Valenzuela JM, Cristante L, Damman O, Bentele K, Vortmeyer A, Saeger W, Padberg B, Freitas J, Herrmann HD: Hypothalamic hamartoma: with special reference to gelastic epilepsy and surgery. Neurosurgery 34: 949-958, 1994.
- Ventureyra EG, Higgins MJ. Complications of epilepsy surgery in children and adolescents. Pediatr Neurosurg 19: 40-56, 1993.
- Villemure JG, Rasmussen T. Functional hemispherectomy. methology. J. Epilepsy 3 (Suppl): 177182, 1990.
- Zeller JA, Schlesinger S, Runge U, Kessler C. Influence of valproate monotherapy on platelet activation and hematologic values. Epilepsia 40: 186-189, 1999.
- Zentner J, Hufnagel A, Ostertun B, Wolf HK, Behrens E, Campos MG, Solymosi L, Elger C, Wiestler OD, Schanan J. Surgical treatment of extratemporal epilepsy: clinical, radiologic and histopathologic findings in 60 patients. Epilepsia 37: 10721080, 1996.
Agradecimiento
A la Dra. Esther Cáceres por la colaboración en la preparación y corrección del presente manuscrito.
