Título
dexmedetomidina y ketorolac en cirugía espinal:
Una estrategia para disminuir el consumo de opioides
2do Premio Beca Asociación Argentina de Neurocirugía.
XV Jornadas de Neurocirugía 2019
Autor
Fecha
Lugar de Realización
Correspondencia
Texto
REV ARGENT NEUROC. | 2019
TRABAJO PREMIADO
RODEXKE. Infiltración con ropivacaína, dexmedetomidina y ketorolac en cirugía espinal:
Una estrategia para disminuir el consumo de opioides
2do Premio Beca Asociación Argentina de Neurocirugía.
XV Jornadas de Neurocirugía 2019
Sebastián Kornfeld, Hernan Bovery, Jorge Rasmussen, Federico Landriel, Santiago Hem, Claudio Yampolsky Hospital Italiano de Buenos Aires. C.A.B.A., Argentina.
RESUMEN
Objetivos: Evaluar la efectividad de la infiltración del sitio quirúrgico, con ropivacaína, dexmedetomidina y ketorolac, en pacientes sometidos a instrumentación transpedicular dorsolumbar con técnica mini invasiva, en cuanto al consumo de opioides durante la internación.
Materiales y métodos: Se recolectaron en forma retrospectiva los datos prospectivos de las historias clínicas de pacientes con una instrumentación con tornillos transpediculares percutáneos operados entre Junio del 2016 y Diciembre del 2018. 32 pacientes cumplieron con los criterios de selección. Se infiltró en el momento del cierre quirúrgico con una solución preparada con 150 mg de ropivacaína, 0,7 mcg/kg de dexmedetomidina y 60 mg de ketorolac, disuelto en solución fisiológica estéril para completar 40ml (Grupo M) y se la comparó con pacientes en los cuales solo se infiltró con 150mg de ropivacaína (Grupo E).
Resultados: El consumo de equivalentes de morfina durante las primeras 72hs postoperatorias presentó en el grupo M una mediana de 0mg, y el grupo E, una mediana de 9,5mg (RIQ de 13,35), con una p<0,000. Por el contrario el consumo de morfina en la sala de recuperación presentó una mediana de 0mg (RIQ de 2) para el grupo M, y de 2mg (RIQ de 5) para el grupo E, sin encontrarse una diferencia significativa, p=0,132.
Conclusión: Los resultados obtenidos en la comparación del consumo de opioides durante las primeras 72hs de la internación permite inferir que esta combinación de fármacos es superior respecto a la infiltración estándar con ropivacaína, independientemente de la estrategia analgésica utilizada durante el tiempo quirúrgico.
Palabras clave: Cirugía Espinal Mínimamente Invasiva; Tornillos Transpediculares Percutáneos; Anestesia Multimodal; Consumo Opioides
ABSTRACT
Objectives: To assess the effectiveness of a surgical site infiltration with ropivacaine, dexmedetomidine and ketorolac, in reducing opioid consumption in patients with a transpedicular dorsolumbar instrumentation using a minimally invasive technique.
Materials y methods: We retrospectively collected data from patient’s charts from June of 2016 to December of 2018. 32 patients with minimally invasive transpedicular dorsolumbar instrumentation, who met all criteria, were included in the analysis. During wound closure a mixture of 150mg of ropivacaine, 0,7mcg/kg of dexmedetomidine and 60mg of ketorolac, diluted in normal saline to achieve 40ml was injected (Group M). We compared them with patients in whom only 150mg of ropivacaine and saline where injected in the surgical site (Group E).
Results: Morphine equivalents use during the first 72 hours postoperative had a median of 0mg for group M, and of 9,5mg (IQR of 13.35), with a p<0,000. On the contrary, morphine use during post anesthesia care unit stance had a median of 0mg (IQR of 2) for group M and of 2mg (IQR of 5) for group E, without a statistically significant difference, p=0,132.
Conclusion: The result of the analysis of opioid consumption during the first 72 hours postoperative allows concluding that the infiltration of these 3 drugs together its superior to the standard infiltration with ropivacaine, independently of the analgesic strategy used during the surgery.
Key words: Minimally Invasive Spine Surgery; Percutaneous Transpedicular Screws; Multimodal Anesthesia; Opioid Analgesics; Ropivacaine
Sebastián Kornfeld
sebask1@gmail.com
Recibido: Agosto de 2019.
Aceptado: Agosto de 2019.
OBJETIVOS
Evaluar la efectividad de la infiltración del sitio quirúrgico, con ropivacaína, dexmedetomidina y ketorolac, en pacientes sometidos a instrumentación transpedicular dorsolumbar con técnica mini invasiva, en cuanto al consumo de opioides durante la internación, como un subrogante del dolor postoperatorio.
INTRODUCCIÓN
La patología espinal degenerativa del adulto es la principal indicación de cirugía lumbar con artrodesis e instrumentación en los adultos mayores de 65 años.25
Entre las complicaciones más frecuentes de la instrumentación espinal, se encuentran la pérdida sanguínea y el dolor postoperatorio elevado,6,10 los cuales redundan en largas estadías postoperatorias y alto consumo de analgésicos opioides y los antiinflamatorios no esteroides (AINES),39 con su morbilidad asociada. El dolor postoperatorio continúa siendo uno de los principales desafíos a resolver en la cirugía espinal.19 Las técnicas mini invasivas de instrumentación de la columna han mejorado la morbilidad, disminuyendo enormemente estas complicaciones.15,36,5,41,39,18,22 Permitiendo entonces ampliar su indicación a pacientes más añosos. Al disminuir la disección muscular se reduce ampliamente el tiempo en el cual el dolor de la herida quirúrgica es un factor crítico. Por lo tanto, las primeras 24-48 horas son las más importantes para ser cubiertas mediante nuevas estrategias analgésicas.
La infiltración durante la cirugía, de los tejidos musculares y el plano subcutáneo con anestésicos locales mejora el dolor durante las primeras horas postquirúrgicas.29,3,16 Diversos anestésicos locales pueden ser usados para este fin, de los cuales la ropivacaína tiene el mejor perfil farmacocinético y de efectos adversos.37,44
Sin embargo la principal desventaja es su duración limitada en el tiempo. Este problema intenta ser superado mediante la adición de adyuvantes a los anestésicos locales, potenciando y prolongando sus efectos. Entre estos, se encuentran la dexmedetomidina, los AINES, y la ketamina.33,27
Estos fármacos intentan mejorar los efectos de la ropivacaína mediante 2 mecanismos. En primer lugar los AINES, como el ketorolac, por su efecto inhibidor de la enzima ciclooxigenasa (COX), disminuyen la concentración de prostaglandinas, agentes sensibilizadores de las terminales nerviosas periféricas. Esto reduce el input nociceptivo generado sobre las fibras aferentes. Su acción, ante la administración local, supera la prevista por sus efectos de distribución sistémica, incluso potenciando los efectos de los anestésicos locales.11,31,20
Los agonistas α2, como la clonidina y la dexmedetomidina, presentan acción analgésica tanto a nivel espinal como a nivel periférico.38,8,40 La coadministración de clonidina junto a anestésicos locales prolonga el tiempo de acción de los mismos en los bloqueos regionales.38,8,14 La dexmedetomidina, un agonista mucho más selectivo de los receptores α2, potencia el efecto de los anestésicos locales antes la administración en la herida quirúrgica, sin intervenir su efecto sistémico.8,38,9,43,42,27
Por lo tanto, en este trabajo proponemos la instilación de 3 fármacos (dexmedetomidina, ketorolac y ropivacaína) a nivel local, a fin de ejercer un efecto sinérgico, potenciando y prolongando la duración de acción respecto de la infiltración aislada con ropivacaína. De esta manera pretendemos lograr una analgesia duradera, una disminución de la activación de la respuesta neurohumoral global al dolor, y por tanto, un menor consumo de analgésicos totales.
MATERIALES Y MÉTODOS
Diseño del estudio: Cohorte retrospectiva
Se recolectaron en forma retrospectiva los datos registrados de manera prospectiva en las historias clínicas de los pacientes en los que se haya utilizado la técnica de instrumentación con tornillos transpediculares percutáneos operados entre Junio del 2016 y Diciembre del 2018. De los 65 pacientes así obtenidos en la selección original, se analizaron los datos de 32 pacientes, los cuales cumplieron con los siguientes criterios.
Criterios de inclusión; cirugía electiva, American Society of Anesthesiologist (ASA) I-III, instrumentación transpedicular dorsal o lumbar percutánea, abordaje posterior exclusivo o combinado con vía anterior/lateral, mayores de 18 años y menores de 80 años.
Criterios de exclusión: cirugía ambulatoria, alergia o sospecha de alergia a anestésicos locales de tipo amida, alergia o sospecha de alergia al ketorolac u otro AINE, consumo crónico preoperatorio de opioides, embarazadas, antecedentes cardiovasculares mayores, insuficiencia renal o hepática, inestabilidad hemodinámica durante o previa a la cirugía, presencia de dolor oncológico refractario, paciente con internación prolongada inmediatamente previa a la cirugía.
Manejo de variables
Como resultado primario se analizó el consumo de equivalentes de opioides durante la internación utilizado como un subrogante del dolor postoperatorio; operacionalizado como una variable continua, miligramos de equivalentes de morfina. Excluye opioides intraoperatorios y administrados en la sala de recuperación. Como resultados secundarios se analizaron el consumo de equivalentes de opioides en la sala de recuperación y el consumo total. Operacionalizado como una variable continua, miligramos de equivalentes de morfina. Tiempo al alta. Operacionalizado como una variable discreta, con horas desde el fin de la cirugía, hasta el alta. Como características de base de los pacientes se analizó la edad, el sexo, el ASA, el número de tornillos colocados y la cirugía acompañante a la instrumentación transpedicular. Esta última se operacionalizó, como una variable dicotómica, en presencia o ausencia de artrodesis intersomática, ya sea una fusión intersomática transforaminal, anterior o lateral. Finalmente se evaluará la presencia de complicaciones postoperatorias en el primer mes, que se operacionalizó como una variable dicotómica, en presencia o ausencia de complicaciones.
Las conversiones de dosis de los equivalentes de morfina se realizaron de la siguiente manera; 50mg de tramadol endovenoso equivalen a 5mg de morfina endovenosa; 50mg de tramadol oral son equivalentes a 3,3mg de morfina endovenosa; 3mg de morfina vía oral equivalen a 1mg de morfina endovenosa.
Análisis estadístico
Se utilizó el software IBM SPSS Statistics for Windows, Version 25.0. (Armonk, NY: IBM Corp) para realizar el análisis estadístico. Debido al tamaño muestral, se decidió realizar un testeo de normalidad para todos los resultados de las variables, mediante el test de Shapiro-Wilks. Como ninguno de los resultados presentó una distribución normal, se utilizó una prueba no paramétrica, el test U de Mann-Whitney para evaluar la diferencia en las dosis de equivalente de opioides. Se utilizó el test exacto de Fisher para evaluar diferencia en la clasificación de ASA, en la presencia de fusión intersomática y en la presencia de complicaciones, según los grupos. Finalmente se utilizó el test de Logrank para comparar el tiempo al alta en ambos grupos. Se consideró como estadísticamente significativo un valor de p<0,05.
Ámbito y aspectos técnicos
La intervención es llevada a cabo en el quirófano central del Hospital Italiano de Buenos Aires por el Servicio de Neurocirugía en el Hospital Italiano de Buenos Aires, con el asesoramiento y colaboración técnica del Servicio de Anestesiología. Los controles clínicos y el seguimiento postoperatorio se realizaron en la sala de recuperación y posteriormente en el piso de internación general.
Técnica de infiltración
Se infiltró en el momento del cierre quirúrgico en los músculos paraespinales posteriores de forma bilateral, el 50% de la dosis preparada. El resto de la dosis se infiltró en el tejido celular subcutáneo aproximadamente a 2 cm alejado de los bordes quirúrgicos, previa aspiración para corroborar no encontrarse en un vaso sanguíneo. La infiltración se hizo con una solución preparada con 150 mg de ropivacaína, 0,7 mcg/kg de dexmedetomidina y 60mg de ketorolac, disuelto en solución fisiológica estéril para completar 40ml.
Manejo de la analgesia
En la sala de recuperación post anestésica, se siguió un protocolo estándar para el manejo del dolor postoperatorio, consistiendo en morfina intravenosa 2 mg cada 15 minutos si dolor mayor o igual a 4 Escala Visual Análoga (EVA).
En la sala de internación general el manejo del dolor se estandarizó con 2 medicaciones regladas. 3000mg diarios de paracetamol, divido en 3 tomas cada 8 horas y 90mg diarios de ketorolac, divido en 3 tomas cada 8 horas. Junto a 2 opciones de rescate analgésico. Tramadol EV u oral, dosificado en 50mg, con un máximo de 200-300mg día; o bien morfina EV, dosificada en 3 mg, con un máximo de 15mg día.
Consideraciones éticas
El estudio se llevó a cabo en total acuerdo con la normativa nacional e internacional vigente: Declaración de Helsinki de la Asociación Médica Mundial, la Resolución 1490/2007 “Guía de las Buenas Prácticas de Investigación Clínica en Seres Humanos”, la ley 3301/2009 CABA “Protección de Derechos de Sujetos en Investigaciones en Salud”, y las Normas de Buenas Prácticas Clínicas ICH E6. La utilización de esta técnica no conllevó ningún riesgo adicional para el paciente, fuera del asociado a la utilización de las drogas en cuestión. Ni modifica la técnica quirúrgica. Tampoco presentará detrimento en los controles clínicos habituales para esta población de pacientes.
Todos los datos del estudio serán tratados con máxima confidencialidad de manera anónima, con acceso restringido sólo para el personal autorizado a los fines del estudio de acuerdo con la normativa legal vigente Ley Nacional de Protección de Datos Personales 25.326 (Ley de Habeas data).
RESULTADOS
Treinta y dos pacientes fueron seleccionados luego de los criterios de exclusión a partir de los 65 pacientes que calificaron por presentar una instrumentación pedicular por vía posterior mínimamente invasiva. Las características de base de los pacientes analizados se resumen en la Tabla 1.
| Variables | Anestesia Estándar (n=20) | Anestesia Multimodal (n=12) | Valor de p |
| Edad – mediana (RIQ) | 60 (12,5) | 65,5 (21) | 0,381 |
| Sexo Femenino – número (%) | 8 (40%) | 5 (42%) | 0,607 |
| ASA | 0,826 | ||
| ASA I | 1(5%) | 1(8,3%) | |
| ASA II | 16(80%) | 8(66,6%) | |
| ASA III | 3(15%) | 3(25%) | |
| ASA IV | 0 | 0 | |
| Numero de tornillos – mediana (RIQ) | 4(2) | 4(1,5) | 0,803 |
| Fusión intersomática TLIF, ALIF o XLIF – número (%) | 16 (80%) | 9 (75%) | 0,535 |
Se realizó un análisis de normalidad sobre todas las variables de la misma, el cual arrojó un resultado que demuestra que no presentan una distribución normal. De los 32 pacientes, a 12 (37,5%) se le administró la infiltración resultando en una anestesia multimodal (Grupo M) y a 20 (62,5%) se realizó técnica anestésica estándar (Grupo E). En el grupo M la mediana de la edad es 65,5 años con un rango intercuartil (RIQ) de 21 y en el grupo E una mediana de 60 años y un RIQ de 12,5. La diferencia entre los mismos no resultó significativa (p=0,381). El porcentaje de mujeres en cada grupo resultó de 42%(grupo M) y 40%(grupo E) (p=0,607). La distribución del riesgo anestésico preoperatorio fue similar, resultando un 66,7% de ASA II para el grupo M y 80% para el grupo E, p=0,826. El número de tornillos presenta una mediana de 4 (RIQ de 1,5) para el grupo M y de 4 (RIQ de 2) para el grupo E (p=0,803). El 75% de los pacientes del grupo M se realizó acompañando a la instrumentación transpedicular una fusión intersomática por alguna vía. En el grupo E, alcanzó el 80%. (p=0,535)
El consumo de equivalentes de morfina durante la internación postoperatoria tampoco presentó una distribución normal. La mediana del grupo M fue de 0mg, presentando únicamente 2 pacientes con consumo de opioides (uno 2mg y otro 5mg) y el grupo E una mediana de 9,5mg (RIQ de 13,35), con una p<0,000 (graf. 1).
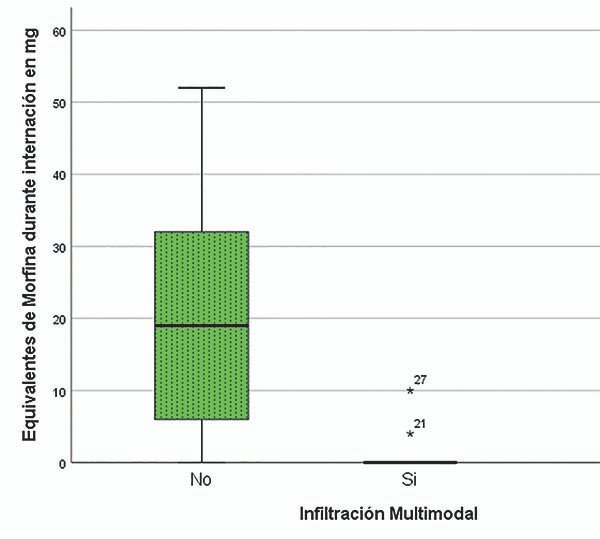
Gráfico 1.
Por el contrario el consumo de morfina en la sala de recuperación presentó una mediana de 0mg (RIQ de 2) para el grupo M, y de 2mg (RIQ de 5) para el grupo E, sin encontrarse una diferencia significativa, p=0,132 (graf. 2).
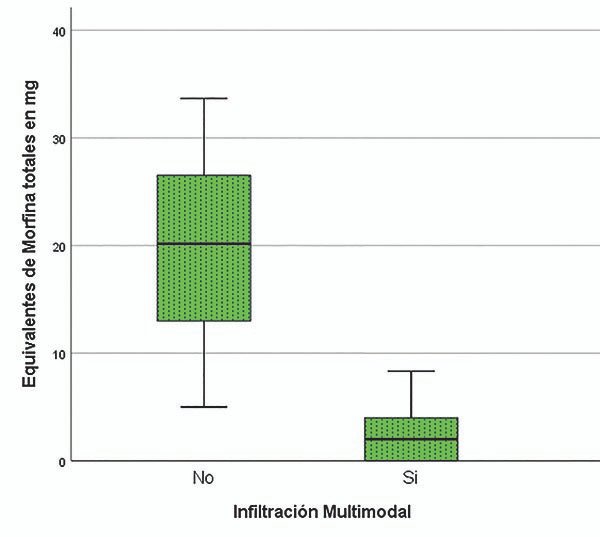
Gráfico 2.
Finalmente el análisis del consumo total de equivalentes de morfina, presentó una mediana de 2mg (RIQ de 4,5) y de 20,17mg (RIQ de 15,25) para los grupo M y E respectivamente. Hallándose una diferencia significativo, p<0,000 (graf. 3).
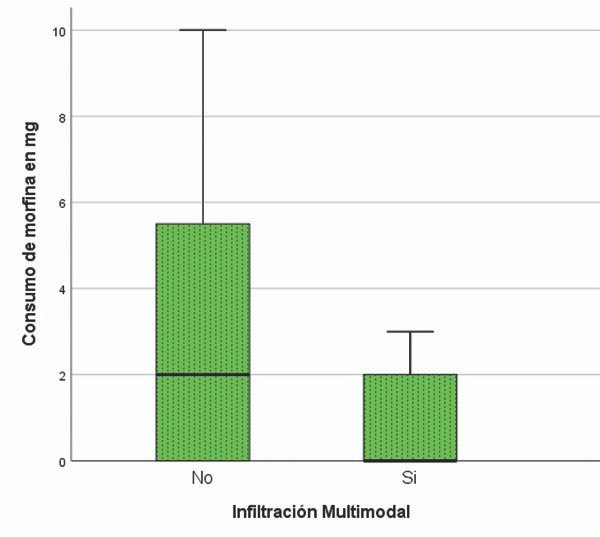
Gráfico 3.
Se realizó un análisis del tiempo al alta, cuyas curvas de sobrevida se pueden apreciar en el gráfico 4. No se halló diferencias significativas entre ambos grupos, p=0,611.
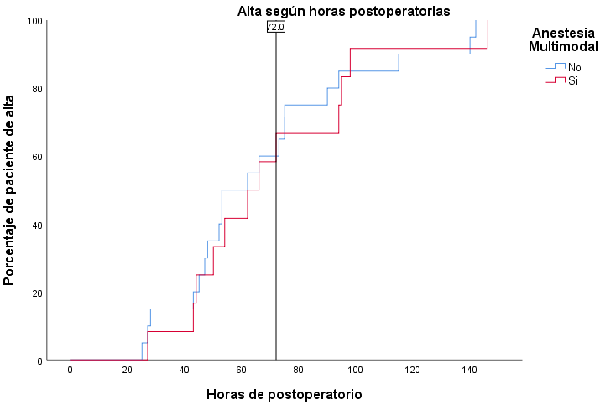
Gráfico 4.
En el análisis de las complicaciones postoperatorias, no se hallaron diferencias significativas entre ambos grupos, p=0,515. Habiendo presentado 3 en grupo el E y 1 en el grupo M.
DISCUSIÓN
El dolor postoperatorio presenta 3 factores determinantes:
- Impulsos generados por las fibras que inervan el sitio quirúrgico afectadas por la incisión, retracción tisular y suturas;
- Mediadores inflamatorios como citoquinas, prostaglandinas, endotelina-1, factor de crecimiento nervioso, que se encuentran elevados en el sitio quirúrgico y que sensibilizan a las fibras nerviosas no dañadas;
- Sensibilización de los circuitos que transmiten el dolor a la médula espinal e incrementan la respuesta a un estímulo doloroso, y que pueden inducir respuesta ante un estímulo no doloroso.32
El consumo excesivo de analgésicos conlleva múltiples efectos adversos como, náuseas, vómitos, constipación, síndrome confusional, insuficiencia renal aguda e hiperalgesia asociada a opioides.2,21,32 Además prolonga el tiempo hasta la deambulación y la micción espontanea de los pacientes en el estadío postquirúrgico inmediato, lo cual retrasa la recuperación funcional y el alta domiciliaria.39 Aumenta también el riesgo de trombosis venosa profunda y embolia pulmonar.4,35 Incluso el dolor postoperatorio mal manejado ha sido asociado como factor de riesgo para desarrollar dolor crónico.19,28
La incisión representa un estímulo nociceptivo agudo, persistente y de relativa intensidad. Este estímulo intenso produce activación de las neuronas del asta posterior medular, asociadas con la sensibilización postquirurgica.12 Mediada por sustancia P y neuroquinina A, entre otras, las cuales poseen acciones periféricas que controlan la sensibilización del sitio quirúrgico. La sustancia P ha mostrado mediar la producción de citoquinas (IL-1β, IL-6 y FNT-α) posterior a la lesión celular por daño tisular o inflamación.34 El dolor posoperatorio es potenciado por la sensibilización de fibras aferentes en los sitios de la lesión. Recientemente los procesos periféricos han ganado atención, los mecanismos por los que se produce hiperalgesia y las prostaglandinas como agentes que propician esta sensibilización.24
La infiltración con anestésicos locales alrededor de la herida quirúrgica suprime la generación y propagación del impulso nervioso durante la manipulación quirúrgica. Esta acción inhibe la transducción, bloqueando el primer eslabón en la nocicepción y reduciendo el efecto sensibilizador. Se han desarrollados diversas estrategias para prolongar los efectos analgésicos de las mismas, por ejemplo, mediante la instilación continua del fármaco a través de una bomba elastomérica y catéteres insertados en los tiempos finales de la cirugía.17,32,23,13,30 Estos son fundamentalmente útiles en abordajes abiertos convencionales que abarquen múltiples niveles espinales. Sin embargo, no están exentas de riesgos, siendo uno de los principales, las infecciones del sitio quirúrgico, morbilidad extremadamente importante en la patología espinal con instrumentación. Asimismo, las altas dosis a flujo continuo de anestésico local pueden causar efectos adversos sistémicos de los mismos,26,37,44 y de menor relevancia, la incomodidad que produce a los pacientes y el control del sistema por el personal de enfermería.
La infiltración local de la herida quirúrgica, mezclando bupivacaína con ketorolac es una técnica efectiva, segura y con un bajo costo.7,11 El ketorolac es un AINE, inhibe la COX 1 Y 2, y por lo tanto la síntesis de prostaglandinas las cuales son mediadores importantes de los procesos inflamatorios y están envueltos en la sensibilización periférica.24 Estos metabolitos del ácido araquidónico son producidos localmente en el sitio de la lesión. La administración local de ketorolac permanece en altas concentraciones en el sitio de la lesión, en donde se origina el proceso inflamatorio, siendo más efectivo, con una dosis plasmática menor por tanto con menos incidencia de efectos adversos.31,1
La dexmedetomidina es un potente agonista de los receptores α2 aproximadamente 8 veces más selectivo que la clonidina. El receptor α2A es el responsable de las propiedades analgésicas en ambos sitios; periféricos y centrales.8,9,38 Si bien, no está claro su mecanismo de acción específico a nivel periférico, varios trabajos evalúan la eficacia de combinar agonistas α2 con anestésicos locales para producir bloqueo nervioso regional o infiltración directa del sitio quirúrgico.42,43,27
La práctica de infiltrar con ropivacaína junto a dexmedetomidina o ketorolac probó tener resultados positivos en diversos tipos de cirugías,20,11,16,29,33,43 por tanto la combinación de ambos, al actuar por mecanismos diferentes, potenciaría el efecto final. Según nuestro conocimiento, la aplicación en cirugía de columna de esta mezcla no ha sido probada. Debido a políticas institucionales, la randomización con doble ciego de la infiltración combinada no pudo ser llevada a cabo y la misma fue instaurada de forma esporádica en diversos pacientes, según criterio del anestesiólogo a cargo. Por tanto, se planteó realizar una revisión retrospectiva mediante la historia clínica, para determinar su efectividad en este tipo de procedimientos. A fin de evitar los posibles confundidores, los criterios de exclusión prolijamente formulados y ejecutados, lo que redundó en un tamaño muestral relativamente pequeño. Sin embargo, como se observa en la Tabla 1 las características de base de ambos grupos resultaron homogéneamente balanceadas.
Otra probable fuente de sesgo es la variabilidad de la técnica anestésica utilizada entre el grupo E y el grupo M, prestándose a la duda si el efecto analgésico fuese secundario a una técnica anestésica diferente y no a la infiltración. Sin embargo esto puede ser refutado en dos niveles. Por un lado, la analgesia administrada durante la estadía del paciente en la sala de recuperación anestésica es un reflejo directo del manejo analgésico durante el tiempo quirúrgico. Por tanto, al no presentar diferencias significativas entre ambos grupos, uno puede inferir que no tuvo gran repercusión sobre el dolor postoperatorio inmediato. Por otro lado, el manejo de la medicación analgésica durante el resto de la internación está estandarizado y a cargo del equipo de Neurocirugía, sin intervención del Servicio de Anestesia. Por tanto, atribuimos la diferencia efectivamente a la intervención realizada.
Como resultado primario se utilizó un subrogante al dolor postoperatorio. Esto se debió a las características retrospectivas del estudio y al subregistro de un score estandarizado y bien administrado del dolor. Por tanto, utilizamos una variable, que dadas las características de la institución tendríamos registros fidedignos. Dado que principalmente el dolor postoperatorio en internación general se realiza con tramadol y morfina, estos se convirtieron a equivalentes de morfina para estandarizar el registro. El consumo de paracetamol y AINES´s fue estandarizado y reglado para todos los postoperatorios de cirugía de columna, como se detalló previamente. Por tanto, la única variable posible fue el consumo de opioides.
El prolongar y potenciar el efecto anestésico local de la ropivacaína no sólo permitiría una analgesia adecuada durante las primeras 24 hs. postoperatorias, sinó que disminuiría la respuesta afectiva y neurohumoral al dolor, mediada por la vía paleoespinotalámica y el hipotálamo. De esta manera evitaría la hiperactivación de la vía espinotalámica tanto a nivel local, por disminuir la sensibilización de las terminales nerviosas. Como a nivel central, por disminuir directamente la aferencia dolorosa y la hiperactivación de los centros superiores. Los resultados obtenidos en la comparación del consumo de opioides durante las primeras 72 hs. de la internación permite inferir que efectivamente esta combinación de fármacos es superior respecto a la infiltración estándar con ropivacaína.
Adicionalmente, se intentó corroborar que el déficit de la administración de opioides durante el intraoperatorio, no sería compensado posteriormente. Con ese fin, se realizó el testeo del consumo total de opioides desde el intraoperatorio, la sala de recuperación y la internación posterior. De la misma manera, el resultado obtenido avala que el consumo global de opioides es mayor en el grupo E, y no se ve compensado luego en el postoperatorio.
Otro supuesto fue que al disminuir el dolor postoperatorio el alta hospitalaria sería más temprana. Esto es debido a que uno de los criterios indispensables de alta es el manejo del dolor con analgésicos por vía oral. Pero los resultados no avalan este supuesto, probablemente porque si bien el dolor local de la herida es manejado adecuadamente por la infiltración, la intervención quirúrgica sobre el tejido óseo y neurológico no se ve afectada por la misma. Probablemente el alta deba estar supeditada principalmente al acto quirúrgico asociado a la instrumentación transpedicular. Pero no podemos, con los datos de nuestro estudio, validar esa teoría.
Finalmente, volvemos a plantear el hecho de que el diseño del estudio posee intrínsecamente alto riesgo de presentar confundidores. Como dijimos previamente, al presentar criterios estrictos para la inclusión de los pacientes, se homogeneizó lo más posible la población, intentando disminuir lo más posible esta dificultad.
CONCLUSIÓN
La infiltración de la herida quirúrgica con ropivacaína se vería potenciada por la adición de ketorolac y dexmedetomidina a la mezcla, mejorando sus efectos analgésicos en el postoperatorio de la cirugía espinal mínimamente invasiva; permitiendo de este modo, la disminución del dolor postoperatorio asociado a la misma.
BIBLIOGRAFÍA
- Andersen LJ, Poulsen T, Krogh B, Nielsen T. Postoperative analgesia in total hip arthroplasty infiltration. Acta Orthop. 2007; 78(2): 187–92.
- Araimo Morselli FSM, Zuccarini F, Caporlingua F, Scarpa I, Imperiale C, Caporlingua A, et al. Intrathecal Versus Intravenous Morphine in Minimally Invasive Posterior Lumbar Fusion: A Blinded Randomized Comparative Prospective Study. Spine (Phila. Pa. 1976). 2017; 42(5): 281–4.
- Bilgin TE, Bozlu M, Atici S, Cayan S, Tasdelen B. Wound infiltration with bupivacaine and intramuscular diclofenac reduces postoperative tramadol consumption in patients undergoing radical retropubic prostatectomy: A prospective, double-blind, placebo-controlled, randomized study. Urology 2011; 78(6): 1281–5.
- Brambilla S, Ruosi C, La Maida GA, Caserta S. Prevention of venous thromboembolism in spinal surgery. Eur. Spine J. 2004; 13(1): 1–8.
- Brodano GB, Martikos K, Lolli F, Gasbarrini A, Cioni A, Bandiera S, et al. Transforaminal Lumbar Interbody Fusion in Degenerative Disk Disease and Spondylolisthesis Grade I. J. Spinal Disord. Tech. 2015; 28(10): 559–64.
- Carreon LY, Puno RM, Dimar JR, Glassman SD, Johnson JR. Perioperative Complications of Posterior Lumbar Decompression and Arthrodesis in Older Adults. J. Bone Jt. Surg. - Ser. A 2003; 85(11): 2089–92.
- Carvalho B, Clark DJ, Angst MS. Local and Systemic Release of Cytokines, Nerve Growth Factor, Prostaglandin E2, and Substance P in Incisional Wounds and Serum Following Cesarean Delivery. J. Pain 2008; 9(7): 650–7.
- Chan AKM, Cheung CW, Chong YK. Alpha-2 agonists in acute pain management. Expert Opin. Pharmacother. 2010; 11(17): 2849–68.
- Cheung CW, Fu K, Ng J, Choi WS, Chiu K, Lun C, et al. Evaluation of the Analgesic Efficacy of Local Dexmedetomidine application. Clin J Pain 2011; 27(5): 377–82.
- Cho KJ, Suk S Il, Park SR, Kim JH, Kim SS, Choi WK, et al. Complications in posterior fusion and instrumentation for degenerative lumbar scoliosis. Spine (Phila. Pa. 1976). 2007; 32(20): 2232–7.
- Connelly NR, Reuben SS, Albert M, Page D, D M. Use of preincisional ketorolac in hernia patients: Intravenous versus Surgical Site. Reg. Anesth. 1997; 22(3): 229–32.
- Dirks J, Møiniche S, Hilsted KL, Dahl JB. Mechanisms of postoperative pain: Clinical indications for a contribution of central neuronal sensitization. Anesthesiology 2002; 97(6): 1591–6.
- Elder JB, Hoh DJ, Liu CY, Wang MY. Postoperative continuous paravertebral anesthetic infusion for pain control in posterior cervical spine surgery: a case-control study. Neurosurgery 2010; 66(3 Suppl Operative): 99–106; discussion 106-7.
- Gabriel JS, Gordin V. Alpha 2 agonists in regional anesthesia and analgesia. Curr. Opin. Anaesthesiol. 2001; 14(6): 751—3.
- Goldstein CL, Macwan K, Sundararajan K, Rampersaud YR. Comparative outcomes of minimally invasive surgery for posterior lumbar fusion: A systematic review. Clin. Orthop. Relat. Res. 2014; 472(6): 1727–37.
- Hannibal K, Galatius H, Hansen A, Obel E, Ejlersen E. Preoperative wound infiltration with bupivacaine reduces early and late opioid requirement after hysterectomy. Anesth. Analg. 1996; 83(2): 376–81.
- Karmakar MK, Booker PD, Franks R. Bilateral continuous paravertebral block used for postoperative analgesia in an infant having bilateral thoracotomy. Paediatr Anaesth 1997; 7(6): 469–71.
- Kim CW, Surgery L. Scientific basis of minimally invasive spine surgery: prevention of multifidus muscle injury during posterior lumbar surgery. Spine (Phila. Pa. 1976). 2010; 35(26 Suppl): 281–6.
- Kim H-J, Park J-H, Kim J-W, Kang K-T, Chang B-S, Lee C-K, et al. Prediction of Postoperative Pain Intensity after Lumbar Spinal Surgery Using Pain Sensitivity and Preoperative Back Pain Severity. Pain Med. 2014; 15(12): 2037–45.
- Kumar A, Srivastava U, Saxena S, Gandhi NK, Joshi S, Payal Y. Comparison of Incisional Infiltration of Ketorolac with or without Bupivacaine Versus Intramuscular Ketorolac for Post-Operative Analgesia. J Anaesth Clin Pharmacol 2005; 21(2): 165–8.
- Li Y, Lu S, Ma SC, Fan HW, Zhao GQ. Effects of patient-controlled epidural analgesia and patient-controlled intravenous analgesia on analgesia in patients undergoing spinal fusion surgery. Am. J. Ther. 2016; 23(6): 1806–12.
- Lin Y, Chen W, Chen A. Comparison between Minimally Invasive and Open Transforaminal Lumbar Interbody Fusion - A Meta-Analysis of Clinical Results and Safety Outcomes..pdf. J Neurol Surg A Cent Eur Neurosurg 2016; 77(1): 2–10.
- Liu SS, Richman JM, Thirlby RC, Wu CL. Efficacy of Continuous Wound Catheters Delivering Local Anesthetic for Postoperative Analgesia: A Quantitative and Qualitative Systematic Review of Randomized Controlled Trials. J. Am. Coll. Surg. 2006; 203(6): 914–32.
- Ma W, St-Jacques B, Cruz Duarte P. Targeting pain mediators induced by injured nerve-derived COX2 and PGE2 to treat neuropathic pain. Expert Opinion on Therapeutic Targets 2012; vol. 16(6): 527–40.
- Martin BI, Deyo RA, Mirza SK, Turner JA, Comstock BA, Hollingworth W, et al. Expeditures and health status among adults with back and neck problems. Jama 2008; 299(6): 656–64.
- Mather LE, Copeland SE, Ladd LA. Acute toxicity of local anesthetics: Underlying pharmacokinetic and pharmacodynamic concepts. Reg. Anesth. Pain Med. 2005; 30(6): 553–66.
- Obayah GM, Refaie A, Aboushanab O, Ibraheem N, Abdelazees M. Addition of dexmedetomidine to bupivacaine for greater palatine nerve block prolongs postoperative analgesia after cleft palate repair. Eur. J. Anaesthesiol. 2010; 27(3): 280–4.
- Perkins FM KH. Chronic Pain as an Outcome of Surgery A Review of Predictive Factors. Anesthesiology 2000; 93(4): 1123–33.
- Qureshi RM, Khan FA. Effects of bupivacaine infiltration on postoperative tramadol consumption in elective day care unilateral inguinal hernia repair. J. Pak. Med. Assoc. 2016; 66(3): 256–9.
- Reynolds RAK, Legakis JE, Tweedie J, Chung Y, Ren EJ, BeVier PA, et al. Postoperative Pain Management after Spinal Fusion Surgery: An Analysis of the Efficacy of Continuous Infusion of Local Anesthetics. Glob. Spine J. 2013; 3(1): 7–13.
- Romsing J, Moiniche S, Ostergaard D, Dahl JB. Local infiltration with NSAIDs for postoperative analgesia : Acta Anaesthesiol Scand 2000; (44): 672–83
- Ross PA, Smith BM, Tolo VT, Khemani RG. Continuous infusion of bupivacaine reduces postoperative morphine use in adolescent idiopathic scoliosis after posterior spine fusion. Spine (Phila. Pa. 1976). 2011; 36(18): 1478–83.
- Röstlund T, Kehlet H. High-dose local infiltration analgesia after hip and knee replacement—what is it, why does it work, and what are the future challenges? Acta Orthop. 2007; 78(2): 159–61.
- Sahbaie P, Shi X, Guo T, Qiao Y, Yeomans DC, Kingery WS, et al. Role of substance P signaling in enhanced nociceptive sensitization and local cytokine production after incision. Pain 2009; 145(3): 341–9.
- Sansone JM, del Rio AM, Anderson PA. The Prevalence of and Specific Risk Factors for Venous Thromboembolic Disease Following Elective Spine Surgery. J. Bone Jt. Surgery-American Vol. 2010; 92(2): 304–13.
- Scheufler K-M, Dohmen H, Vougioukas VI. Percutaneous Transforaminal Lumbar Interbody Fusion for the Treatment of Degenerative Lumbar Instability. Oper. Neurosurg. 2007; 60(April): 203–13.
- Scott DB, Lee A, Fagan D, Bowler GM, Bloomfield P, Lundh R. Acute toxicity of ropivacaine compared with that of bupivacaine. Anesth Analg 1989; 69(5): 563–9.
- Smith H, Elliott J. Alpha2 receptors and agonists in pain management. Current Opinion in Anaesthesiology 2001; vol. 14(5): 513–8.
- Street JT, Lenehan BJ, Dipaola CP, Boyd MD, Kwon BK, Paquette SJ, et al. Morbidity and mortality of major adult spinal surgery. A prospective cohort analysis of 942 consecutive patients. Spine J. 2012; 12(1): 22–34.
- Talke P, Richardson CA, Fisher DM. Postoperative Pharmacokinetics of Dexmedetomidine. Anesth Analg 1997;85:113642) 1997; 85: 1136–42.
- Virdee JS, Nadig A, Anagnostopoulos G, George KJ. Comparison of peri-operative and 12-month lifestyle outcomes in minimally invasive transforaminal lumbar interbody fusion versus conventional lumbar fusion. Br. J. Neurosurg. 2017; 31(2): 167–71.
- Yoshitomi T, Kohjitani A, Maeda S, Higuchi H, Shimada M, Miyawaki T. Dexmedetomidine enhances the local anesthetic action of lidocaine via an α-2a adrenoceptor. Anesth. Analg. 2008; 107(1): 96–101.
- Yu JM, Sun H, Wu C, Dong CS, Lu Y, Zhang Y. The Analgesic Effect of Ropivacaine Combined with Dexmedetomidine for Incision Infiltration after Laparoscopic Cholecystectomy. Surg. Laparosc. Endosc. Percutaneous Tech. 2016; 26(6): 449–54.
- Zink W, Graf BM. The toxicity of local anesthetics: The place of ropivacaine and levobupivacaine. Curr. Opin. Anaesthesiol. 2008; 21(5): 645–50.
