Título
Autor
Fecha
Lugar de Realización
Correspondencia
Texto
REV ARGENT NEUROC. | 2019
ARTÍCULO ORIGINAL
Parte I: Anatomía microquirúrgica tridimensional de la ínsula
Gustavo Rassier Isolan1,2, Alvaro Campero3, Pablo Ajler4, Edgar Manuel Garcete Farina5,6,
Thomas M Frigeri1, Leandro Infantini Dini1
1Centro Avançado de Neurologia e Neurocirurgia (CEANNE), Porto Alegre, RS, Brasil.
2Departamento de Neurología y Neurocirugía, Hospital Moinhos de Vento, Porto Alegre, RS, Brasil.
3Departamento de Neurocirugía, Hospital Padilla, Tucumán, Universidad Nacional de Tucumán, Argentina.
4Departamento de Neurocirugía, Hospital Italiano de Buenos Aires, Buenos Aires, Argentina.
5Departamento de Neurocirugía, Hospital ministro Costa Cavalcanti, Foz do Iguaçu, PR, Brasil.
6Departamento de Neurocirugía, Sanatório Le Blanc, Ciudad del Este, Paraguay.
RESUMEN
Introducción: El lóbulo de la ínsula, o ínsula, se encuentra oculto en la superficie lateral del cerebro. La ínsula está localizada profundamente en el surco lateral o cisura silviana, recubierta por los opérculos frontal, parietal y temporal.
Objetivo: Estudiar la compleja anatomía del lóbulo de la ínsula, una de las regiones de mayor complejidad quirúrgica del cerebro humano, y su correlación anatómica con casos quirúrgicos.
Material y Métodos: En la primera parte de este estudio presentamos los resultados de nuestras disecciones microquirúrgicas en fotografías 2 D y 3D; en la segunda parte de nuestro trabajo, la correlación anatómica con una serie de 44 cirugías en pacientes con tumores de la ínsula, principalmente gliomas, operados entre 2007 y 2014.
Resultados: Extenso conjunto de fibras subcorticales, incluyendo el fascículo uncinado, fronto-occipital inferior y el fascículo arcuato, conectan la ínsula a las regiones vecinas. Varias estructuras anatómicas responsables por déficits neurológicos severos están íntimamente relacionadas con la cirugía de la ínsula, tales como lesiones de la arteria cerebral media, cápsula interna, áreas del lenguaje en el hemisferio dominante y arterias lenticuloestriadas.
Conclusión: El entrenamiento en laboratorio de neuroanatomía, estudio de material impreso en 3D, el conocimiento sobre neurofisiología intra-operatoria y el uso de armamento neuroquirúrgico moderno son factores que influencian en los resultados quirúrgicos.
Palabras Clave: Ínsula; Anatomía Microquirúrgica; Neuroanatomía Tridimensional
ABSTRACT
Introduction: The insular lobe, or insula, is the cerebral lobe sitting deep in the sylvian fissure and hidden by the lateral surface of the brain. It is covered by the frontal, parietal and temporal operculum.
Objectives: To study the anatomy of the insular lobe, one of the most complex parts of the human brain, and to correlate this anatomy with intraoperative findings.
Materials and Methods: In the first part of this article we show the results of our dissections, documented in 2D and 3D, and focus on microsurgical anatomy. In the second part we correlate the anatomical structures with intraoperative findings from 44 insular tumor surgeries, mainly gliomas, of patients operated on from 2007 to 2014.
Results: Huge bundles of subcortical fibers, like uncinate, inferior fronto-occipital and arcuate fascicles, connect the insula to the neighboring structures. Several anatomical structures related to neurological disabilities are closely related to insular surgery, like the middle cerebral artery, internal capsule, lenticulostriate arteries and cortical and subcortical language circuits.
Conclusions: Microsurgical laboratory training, 3D documentation, knowledge of brain mapping and modern neurosurgical armamentarium are important factors in achieving good results with insular glioma tumors.
Keywords: Insula; Microsurgical Anatomy; Three Dimensional Neuroanatomy
Los autores declaran no tener ningún conflicto de interés.
Gustavo Rassier Isolan
drgustavoisolan@gmail.com
Recibido: Junio de 2019.
Aceptado: Octubre de 2019.
INTRODUCCIÓN
El Lóbulo de la ínsula, o ínsula, es el lóbulo cerebral que se encuentra escondido en la superficie lateral del cerebro. La ínsula está localizada profundamente en el surco lateral o cisura silviana, cubierta por los opérculos frontal, parietal y temporal. Extensos conjuntos de fibras subcorticales, conectan la ínsula a las regiones fronto-orbital, temporo-polar y la región temporomesial. Varias estructuras anatómicas responsables por déficits neurológicos severos están íntimamente relacionadas con la cirugía en la ínsula, tales como lesiones de la arteria cerebral media, cápsula interna, áreas del lenguaje en el hemisferio dominante y las arterias lenticuloestriadas. La compleja anatomía del lóbulo de la ínsulahace de ésta una de las regiones de mayor complejidad quirúrgica del cerebro cuerpo humano.
Considerando la curva evolutiva de la neurocirugía moderna, el lóbulo de la ínsula, así como el seno cavernoso y otras regiones complejas de la anatomía cerebral eran hasta hace poco tiempo “No man’s land”. En relación a cirugía para tumores de ínsula, el trabajo innovador del Profesor Yasargil et al.65 – publicado en 1992 – evidenció que la remoción de tumores envolviendo este lóbulo eran, en verdad, menos arriesgado de lo que inicialmente se consideraba.
Sabiendo que la anatomía de la ínsula es compleja,5,12,16-18,21-30,33,38,40,46-48,55-66 varios nuevos estudios han demostrado que es posible remover tumores insulares teniendo baja incidencia de complicaciones.1-11,13-15,19-21,31-37,39-45,49-54,62-67
El objetivo de la primera parte de este estudio es presentar nuestros resultados de anatomía microquirúrgica del lóbulo de la ínsula usando metodología de impresión tridimensional anaglífica estereoscópica.
MATERIAL Y MÉTODOS
Disección anatómica
Catorce cerebros humanos y cinco cabezas de cadáveres fijados en formol fueron disecados utilizando microscopio quirúrgico, ampliado 3X a 40X. Diez de los cerebros y todas las cabezas fueron inyectados con silicona coloreada. Fue realizada la técnica de disección de fibras blancas con técnica de Klingler en cinco cerebros no inyectados. En otros 5 cerebros fueron efectuados cortes coronal, sagital y axial. Cada cabeza fue colocado en soporte de Mayfield, extendida y rotada para simular la posición quirúrgica. La craneotomía pterional y el abordaje trans-silviano fueron realizados de acuerdo con las descripciones del Profesor MG Yasargil. Las disecciones fueron hechas en el laboratorio de microcirugía del Hospital Beneficiencia Portuguesa de Sao Paulo, Brasil y en el laboratorio de microcirugía Diane e Gazi Yasargil, Universidad de Arkansas para Ciencias Médicas, en Little Rock.
Diez cabezas fijadas en formalina y con los vasos inyectados con silicona azul y roja para resaltar las arterias y las venas fueron disecadas en el laboratorio de Microcirugía de la Universidad de Florida.
Método de documentación fotográfica 3D anaglífica
Las disecciones anatómicas fueron documentadas utilizando la técnica para obtención de imágenes tridimensionales (3D), para la producción de impresiones estereoscópicas. En esta técnica, el mismo objeto es fotografiado a partir de dos posiciones diferentes, en un mismo plano horizontal. La primera corresponde a una visión del ojo izquierdo y la segunda la del ojo derecho. Las imágenes fueron superpuestas con un Software especial (http://mac.clauss-net.de/redgreen/), luego impresas. La utilización de anteojos 3D con lentes rojo y verde es necesaria para la visualización de las imágenes impresas en el modelo anaglífico. Con la finalidad de documentar las disecciones se empleó una máquina fotográfica digital Nikon D70 de 8,0 megapíxel con lente macro. El aparato fue adaptado a una barra deslizante con una grilla especial milimetrada montada en el trípode. El diafragma y la velocidad del disparo fueron ajustadas en f32 y 1/60 segundos, respectivamente. La técnica de estereoscopía utilizada por los autores se encuentra detallada en un estudio previo.46 Las fotos impresas en el método estereoscópico deben ser visualizadas con anteojos estereoscópicos en los colores rojos y verdes.
RESULTADOS
Las Figuras 1 a 31 demuestran los aspectos anatómicos.

Figura 1: Visión lateral (A, B, C, D), superior (E) y oblicua (F) de los surcos, giros, ínsula y ventrículos. Las líneas verdes en la figura B muestra la ascendiente, anterior y ramo superior de la incisura silviana. 1) Cápsula óptica (canales semicirculares) y nervio facial; 2) Vena de Labbé; 3) Seno transverso; 4) Vena silviana superficial; 5) Parte triangular del giro frontal inferior; 6) Surco circular inferior; 7) Ínsula (giros cortos); 8) Ínsula (giros largos); 9) Cabeza del núcleo caudado; 10) Fisura coroidea; 11) Talamos; 12) Foramen de Monro; 13) Planum polar; 14) Giro de Heschel (giro temporal transverso anterior); 15) Plexo coroideo; 16) Cápsula interna; 17) Seno petroso superior; 18) Surco central da ínsula.
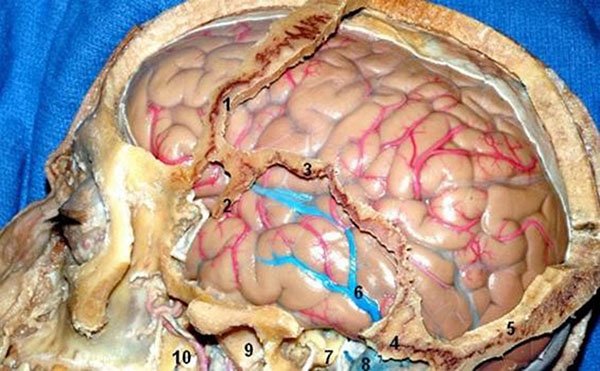
Figura 2: Visión lateral del hemisferio cerebral izquierdo mostrando su relación con las suturas del cráneo. 1) Sutura coronal; 2) Parte anterior de la sutura coronal; 3) Sutura escamosa; 4) Asterión; 5) Sutura lambdoidea; 6) Vena de Labbé; 7) Cápsula óptica; 8) Seno sigmoide; 9) Fosa condilar; 10) Placa pterigoidea lateral.
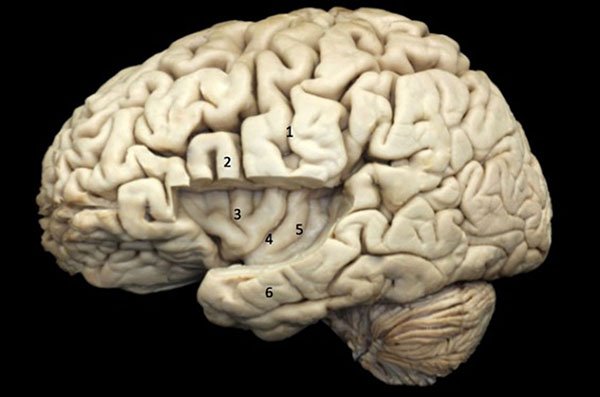
Figura 3: Cara lateral hemisferio cerebral izquierdo (removido parte del opérculo fronto-parietal y giro temporal superior para exponer la ínsula). 1) Surco central; 2) Pars opercularis; 3) Giro corto de la ínsula; 4) Surco central de la ínsula; 5) Giro largo de la ínsula; 6) Giro temporal medio.
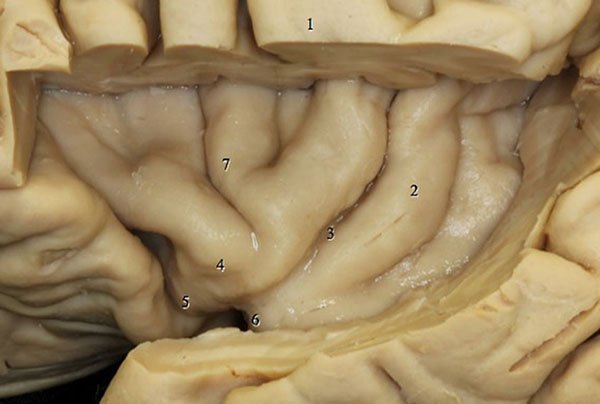
Figura 4: Visión ampliada de la ínsula izquierda después la remoción de parte del opérculo fronto-parietal y giro temporal superior). 1) Giro pre-central; 2) Giro largo de la ínsula; 3) Surco central de la ínsula; 4) Ápex de la ínsula; 5) Giro transverso; 6) Limen de la ínsula; 7) Giro corto de la ínsula.
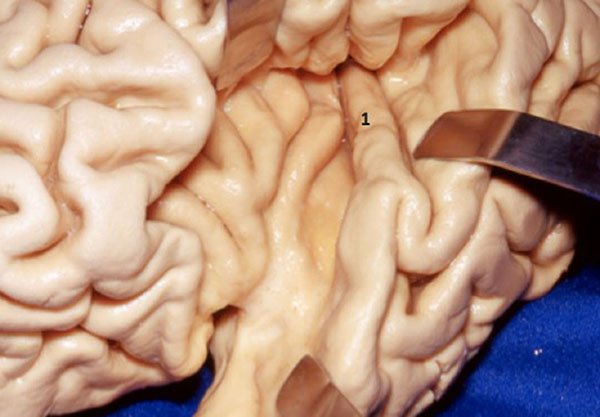
Figura 5: Visión lateral del lóbulo insular izquierdo evidenciando la orientación del giro de Heschel (1) para el surco limitante (peri-insular) posterior en dirección a la región del atrium ventricular.

Figura 6: Visión 3D anaglífica de la figura 5.
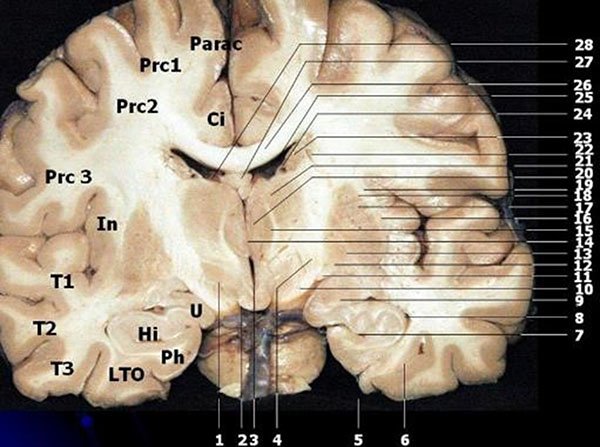
Figura 7: Sección coronal a través de los cuerpos mamilares y núcleos anteriores del tálamo. 1) Fascículo lenticular; 2) Cuerpos mamilares; 3) Tercer ventrículo; 4) Pierna posterior de la cápsula interna; 5) Surco colateral; 6) Surco occipito-temporal; 7) Fisura hipocampal; 8) Cuerno temporal del ventrículo lateral; 9) Amígdala; 10) Pedúnculo cerebral; 11) Tracto óptico; 12) Globo pálido medial; 13) Lámina medular interna; 14) Masa Intermedia; 15) Tracto mamilo-talámico; 16) Claustrum; 17) Putamen; 18) Cápsula externa; 19) Cápsula extrema; 20) Núcleos anteriores del tálamo; 21) Núcleos ventrales tálamo; 22) Estrías lentículo-caudadas; 23) Núcleo caudado; 24) Estría terminal y vena tálamo-estriada; 25) Cuerno frontal del ventricular lateral; 26) Cuerpo caloso; 27) Fórnix; 28) Plexo coroideo. U: uncus, HI: Hipocampo, Ph: Parahipocampo, LTO: giro occipito-temporal lateral, T1: giro temporal superior, T2: giro temporal medio, T3: giro temporal inferior, In: Ínsula, Prc 1: porción superior del giro pre-central, Prc 2: porción medio del giro pre-central, PRC 3: porción inferior del giro pre-central, Parac: giro Paracentral, CI: giro del cíngulo.

Figura 8: Sesión coronal a través de la substancia negra, cuerpo geniculado lateral y cara ventral del puente. 1) Núcleo rubro; 2) Fibras transversales; 3) Núcleos pontinos; 4) Substancia nigra; 5) Decusación del pedúnculo cerebelar Superior; 6) Cuerpo geniculado lateral; 7) Fimbria del fórnix; 8) Surco Colateral; 9) Surco temporo-occipital; 10) Surco temporal inferior; 11) Hipocampo; 12) Cuerno temporal del ventrículo lateral; 13) Núcleo talámico centro-mediano; 14) Habénula y comisura habenular; 15) Estrías medulares del tálamo; 16) Putamen; 17) Córtex Insular; 18) Aspecto caudal de la pierna posterior de la cápsula interna; 19) Fórnix; 20) Núcleo caudado; 21) Cuerpo caloso. U: uncus, Hi: hipocampo, Ph: Parahipocampo, LTO: giro temporo-occipital, lateral, T1: giro temporal superior, T2: giro temporal medio, T3: giro temporal inferior, In: ínsula Post. 1: porción superior del giro pos-central, Post. 2: porción media del giro pos-central, Post. 3: porción inferior del giro pos-central, Parac: giro Paracentral, Ci: giro del cíngulo.

Figura 9: Sesión. Sagital a través hipocampo. 1) Córtex insular; 2) Hipocampo; 3) Surco colateral; 4) Alveus y fimbria del fórnix; 5) Cuerno temporal del ventrículo lateral; 6) Hipocampo, aspecto rostral; 7) Cuerno Temporal; 8) Amígdala; 9) Cauda del núcleo caudado; 10) Putamen.

Figura 10: Perspectiva superior (A, B, C, F) y lateral (D, E) evidenciando las relaciones anatómicas del hipocampo con el lobo de la ínsula. 1) Techo de la órbita; 2) Seno sagital superior; 3) Arteria Carótida interna; 4) Cápsula interna; 5) Piso de la fosa media; 6) Eminencia Colateral; 7) Hipocampo; 8) Calcar avis; 9) Bulbo del Cuerpo calloso; 10) Fisura coroidea; 11) Tálamo; 12) Cabeza del núcleo caudado; 13) Fórnix de 14) Pulvinar del tálamo; 15) Fisura coroidea (parte atrial); 16) Fórnix; 17) Foramen de Monro; 18) Giro corto de la ínsula; 19) Globo pálido; 20) Cápsula interna; 21) Pulvinar del tálamo; 22) Núcleo caudado; 23) Vena cerebral interna; 24) Vena de Galeno; 25) Nervio Oculomotor; 26) Arteria cerebral posterior; 27) Vena basilar o basal de Rosenthal; 28) Arterias hipocampales 29) Giro dentado; 30) Arteria hipocampal posterior; 31) Tienda del cerebelo.
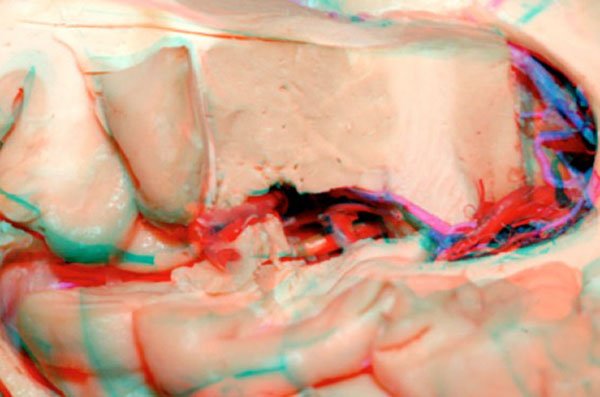
Figura 11: Visión tridimensional anaglífica de la figura 10D.

Figura 12: Visión superior de la relación entre el córtex insular y la arteria cerebral media con los ganglios de la base y ventrículo lateral. Podemos observar la correspondencia entre el segundo giro corto de la ínsula (1) y el foramen de Monro (2).
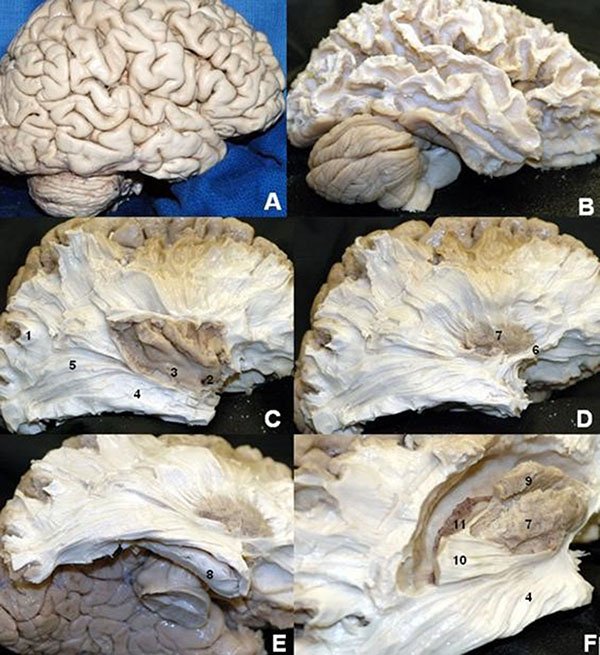
Figura 13: Visión de la cara lateral del hemisferio cerebral derecho a través de la disección de fibras blancas por la técnica de Klinger. 1) Fibras en “U”; 2. Valécula; 3) Córtex insular; 4) Alza de Meyer; 5) Estrato sagital; 6) Fascículo uncinado; 7) Putamen; 8) Hipocampo; 9) Núcleo caudado; 10) Fascículo occipitofrontal 11) Plexo coroideo.
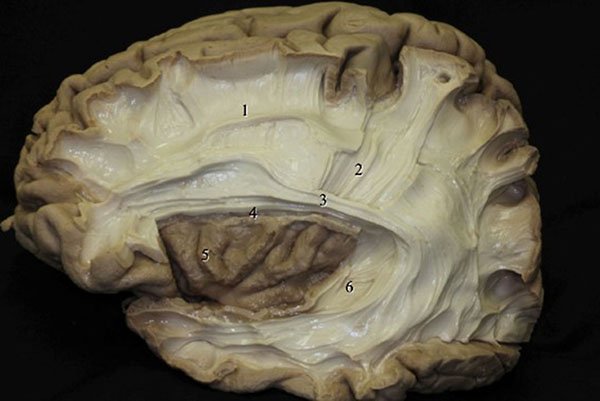
Figura 14: Cara lateral del hemisferio cerebral izquierdo (después de la remoción de la substancia gris y de las fibras en “U”). 1) Fascículo longitudinal; 2) Cápsula interna; 3) Fascículo arqueado; 4) Surco circular de la ínsula (parte superior); 5) Giro corto de la ínsula; 6) Estrato sagital.

Figura 15: Visión de la cara lateral del hemisferio cerebral izquierdo a través de la disección de fibras blancas por la técnica de Klinger. Fibras en “U” comunicando los giros insulares (2). Fascículo arqueado (1).
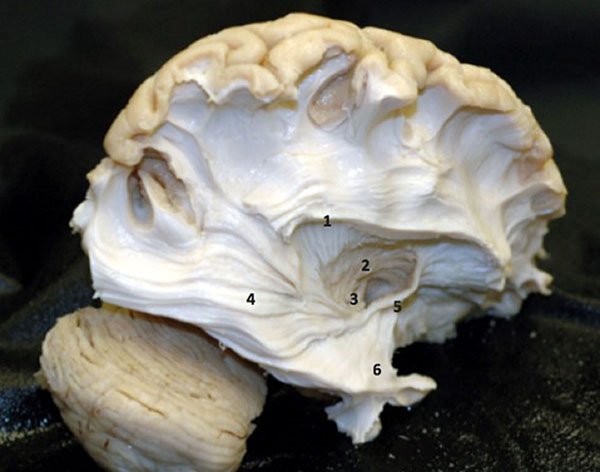
Figura 16: Visión de la cara lateral del hemisferio cerebral derecho a través de la disección de fibras brancas por la técnica de Klinger. 1) Fascículo arqueado; 2) Globo pálido; 3) Comisura anterior; 4) Radiación óptica; 5) Fascículo uncinado; 6) Alza de Meyer.
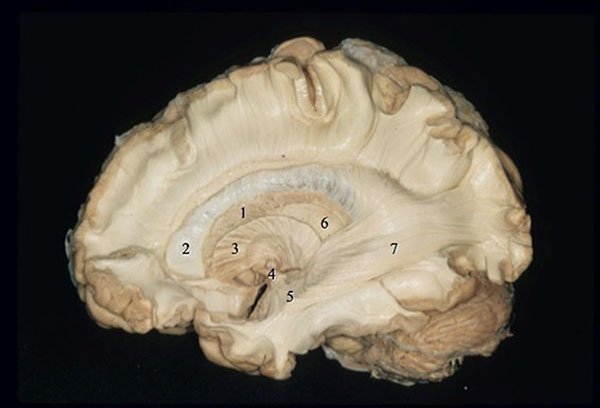
Figura 17: Visión de la cara lateral del hemisferio cerebral derecho a través de la disección de fibras blancas por la técnica de Klinger. 1) Núcleo caudado; 2) Cuerno frontal del ventrículo lateral; 3) Cápsula interna (brazo anterior); 4) Comisura anterior; 5) Alza de Meyer; 6) Tálamo; 7) Radiación óptica.
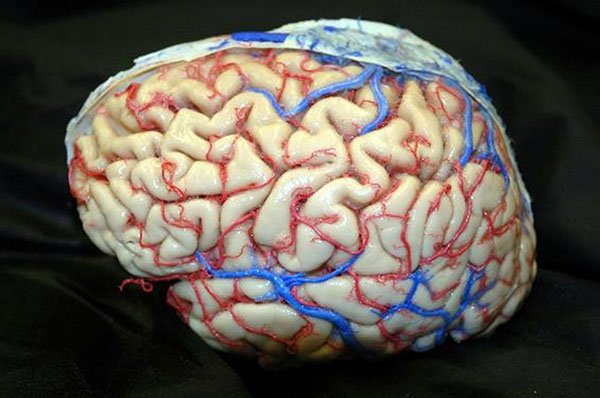
Figura 18: Relaciones arteriales del hemisferio cerebral izquierdo evidenciando los ramos corticales de la arteria cerebral media (M4).

Figura 19: Relación de los ramos corticales de la arteria cerebral media con las principales suturas del cráneo, a partir de estas medidas se calcula las relaciones entre las suturas y los surcos y giros.

Figura 20: Visión ampliada de la fisura silviana y la región opercular derecha. 1) Pars opercularis; 2) Pars triangularis; 3) Pars orbitalis; 4) Giro temporal superior; 5) Vena anastomótica de Labbé; 6) Ramo ascendente de la fisura silviana; 7) Giro sub-central.
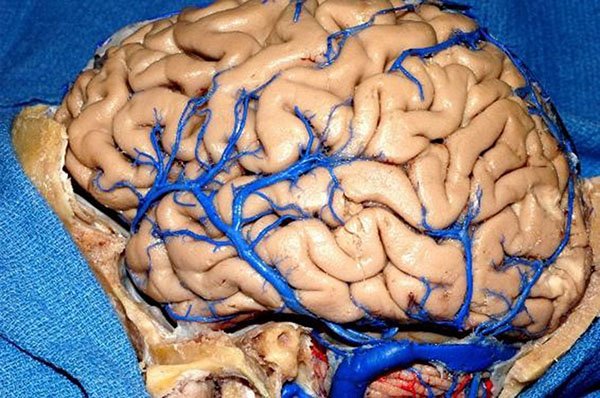
Figura 21: Visión lateral del hemisferio cerebral derecho evidenciando la relación das venas silviana superficiales con la vena de Labbé y su drenado en la junción de los senos sigmoide y transverso.

Figura 22: Cara lateral del hemisferio cerebral izquierdo (removido parte del opérculo fronto-parietal para exponer la ínsula). 1) Pars triangularis; 2) Giro corto de la ínsula; 3) Giro largo de la ínsula; 4) Tronco Inferior de la ACM (Segmento M2); 5) Trifurcación de la ACM; 6) Giro temporal superior.
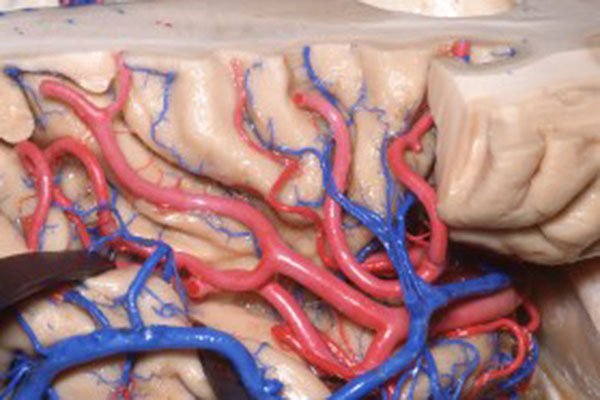
Figura 23: Visión lateral de la ínsula derecha evidenciando el trayecto de los ramos M2 de la arteria cerebral media al largo de los surcos insulares.
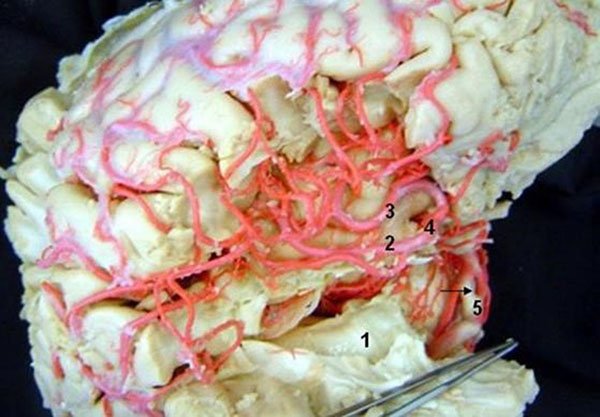
Figura 24: Visión lateral derecha mostrando las relaciones de la ínsula con hipocampo a través del surco circular inferior de la ínsula. 1) Hipocampo; 2) Arteria cerebral media, parte M2 (tronco inferior); 3) Arteria cerebral media, parte M2 (tronco superior); 4) Bifurcación de la arteria cerebral media; 5) Fenestración de la arteria basilar (flecha).
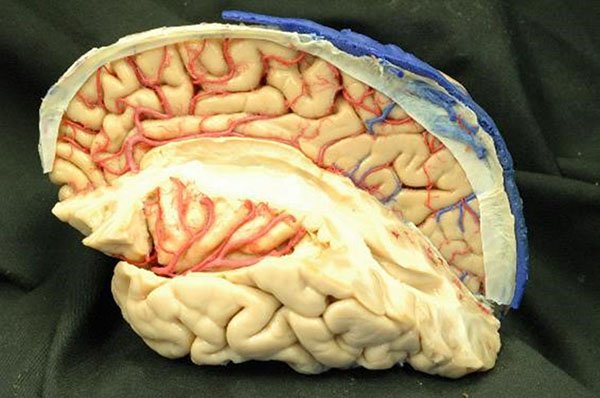
Figura 25: Relación de los segmentos M2 da arteria cerebral media con los giros insulares.

Figura 26: Visión superior oblicua de la ínsula derecha después abertura de la fisura silviana evidenciando las relaciones entre la arteria cerebral media y la ínsula.

Figura 27: Variación anatómica de la Arteria cerebral media (pseudo-tetrafurcación).
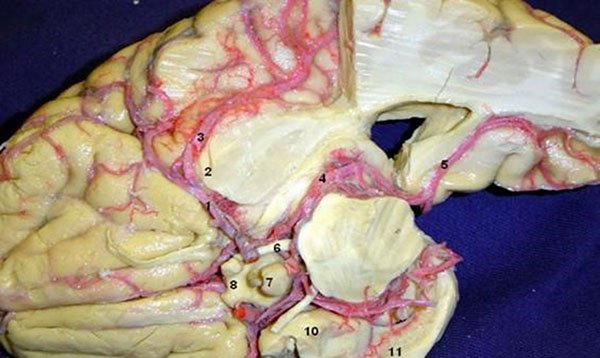
Figura 28: Vista inferior. 1) Arteria cerebral media (segmento M1) con ramos perforante (arteria lentículo-estriadas); 2) Limen de la ínsula; 3) Arteria cerebral media (segmento M2); 4) Arteria cerebral posterior; 5) Arteria calcarina 6) Nervio oculomotor; 7) Glándula pituitaria; 8) Quiasma Óptico; 9) Arteria carótida interna; 10) Uncus; 11) Giro dentado.

Figura 29: Visión superior de las relaciones arteriales de la fisura silviana y de las arterias lentículo-estriadas (círculo). 1) Arteria carótida interna supraclinoidea; 2) Arteria cerebral media (M1); 3) Arteria cerebral anterior (segmento A1); 4) Nervio óptico; 5) Infundíbulo hipofisario; 6) Quiasma óptico; 7) Lámina terminalis; 8) Arteria cerebral anterior (segmento A2); 9) Arteria comunicante posterior.* Arteria de Heubner.

Figura 30: Visión tridimensional anaglífica de la figura 29.
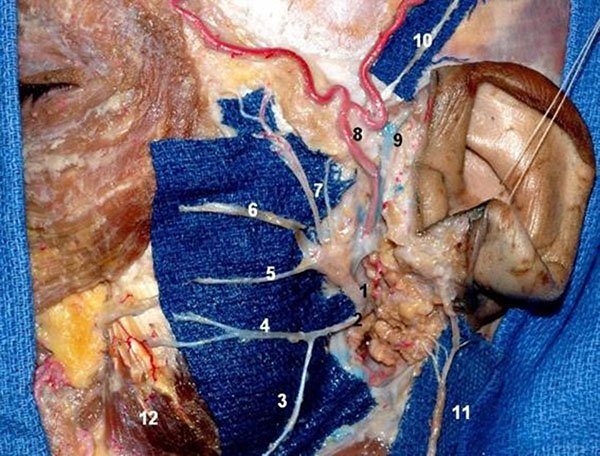
Figura 31: Visión lateral que muestra el ramo fronto-orbital del nervio facial. El estudioanatómico del exacto posicionamiento de los ramos fronto-orbitales del nervio facial esimportante durante la craneotomía pterional para evitar lesiones o tracción de estosnervios. La glándula parótida fue removida para exponer ramos del nervio facial. 1)Nervio facial (tronco superior); 2) Nervio facial (tronco inferior); 3) Ramo cervical; 4) Ramo mandibular; 5) Ramo bucal; 6) Ramo zigomático; 7) Ramo fronto-orbital; 8) Laarteria temporal superficial; 9) Vena temporal superficial; 10) Nervio auriculotemporal;11) Nervio auricular magno; 12) Músculo masetero.
Anatomía topográfica
La ínsula tiene una forma triangular, cuyo vértice es llamado de limen de la ínsula y constituye el límite lateral de la fisura silviana. Se encuentra separada de los opérculos por los surcos peri-insulares, que son tres: superior, inferior y anterior. El surco peri-insular superior está localizado debajo del opérculo frontoparietal; el inferior, debajo del opérculo temporal; y el anterior, debajo del opérculo orbitofrontal. Otro surco presente en la ínsula es el surco central, que se extiende desde el surco peri-insular superior hasta el limen de la ínsula. El divide la ínsula en porción anterior y porción posterior. La porción anterior contiene a los giros cortos anterior, medio y posterior; además giros accesorio y transversal.
Todos estos giros unen para formar el vértice de la ínsula. La porción posterior es formada por los giros largos anterior y posterior, que son separados por el surco pos-central de la ínsula. La región inferior de la ínsula está constituida por tres estructuras: polo de la ínsula, limen de la ínsula y la región lateral del tronco de la fisura silviana.
Surco lateral: junto con el surco central, se inicia en la base del cerebro, más específicamente en la altura de la apófisis clinoides anterior, y se extiende hasta la cara supero-lateral del cerebro, separando el lóbulo frontal del lóbulo temporal. En la parte terminal, se divide en tres ramos: ascendente, horizontal y posterior. El ramo posterior es el más largo de los tres y se dirige hacia atrás y hacia arriba, terminando en el giro supramarginal. Los ramos horizontal y ascendente son cortos y dividen el giro frontal inferior en tres partes: orbital, triangular y opercular. Entre la parte orbital y la triangular, se encuentra el ramo horizontal; y entre la parte triangular y la opercular, y el ramo ascendiente.
El surco lateral puede tener un cuarto ramo, llamado fronto-orbital. Cuando presenta, este es visualizado en el lóbulo frontal, abajo del ramo anterior y de la parte orbital, separando esta parte del giro orbital posterior.55
Vascularización de la ínsula
Relaciones arteriales: La arteria cerebral media es la más compleja de las tres arterias cerebrales. Ella es dos veces más grande que la arteria cerebral anterior, mide de 2.4 a 4,6 mm de diámetro. Su origen está localizado en el inicio de la cisura silviana, lateralmente al quiasma óptico. Durante su trayecto, la arteria cerebral media pasa por debajo de la sustancia perforada anterior, en la cual penetraran sus pequeños ramos llamados arterias lenticuloestriadas laterales. Luego de un recorrido variable, se divide en el interior de la cisura silviana y gira hacia posterior y superior, llegando a la superficie de la ínsula.
La arteria cerebral media está divida en cuatro segmentos, que va desde M1 hasta M4. El segmento M1, también llamado esfenoidal, tiene su origen en la bifurcación de la arteria carótida interna. El segmento M2, o conocido como insular, se extiende desde el límen de la ínsula hasta el surco peri-insular. El segmento M3, u opercular, comienza en el surco peri-insular y recorre los opérculos, terminando en la superficie lateral de la fisura de Silvio. Y por fin, el segmento M4, o para-silviano, corresponde a los ramos que irrigan a la convexidad cerebral.
Segmento M1
La arteria carótida interna se bifurca en la arteria cerebral media y arterial cerebral anterior al nivel de la porción central de la substancia perforada anterior. A partir del origen de la arteria cerebral media es que se inicia el segmento M1. Ella recorre la profundidad del surco de Silvio de forma antero-superior, superior o postero-superior, alrededor del limen de la ínsula, donde forma una curvatura. En ella se delimita el punto final de M1, marcado por la bifurcación principal de la arteria cerebral media en troncos superiores e inferior. Esa bifurcación está localizada en la mayoría de las veces en la rodilla, pero puede estar proximal o distalmente a él. En algunos casos, puede ocurrir la formación de una trifurcación, a través del origen de un tronco intermediario, que puede surgir tanto del tronco superior o del inferior. Puede surgir también una cuadrifurcación, encontrados pocos casos en la literatura.23
Puede ocurrir también la presencia de una falsa bifurcación, formada por el ramo temporal del segmento M1 o por el ramo frontal. Segun Türe y Yasargil, esa variación fue encontrada en dos de los 40 hemisferios evaluados. En todos los casos encontramos el patrón de bifurcación, excepto en un caso de cuadrifurcación.57
Los ramos del segmento M1 son clasificados de acuerdo con el área cerebral que ellos irrigan. Por lo tanto, ellos pueden ser divididos en arterias corticales o en arterias lenticuloestriadas laterales (LLAs).
En relación a las arterias corticales, el segmento M1 es dividido en pre-bifurcación y pos-bifurcación. La pre-bifurcación es compuesta por un único tronco que tiene su origen en el inicio de la arteria cerebral media y se extiende hasta la bifurcación del segmento M1. Las arterias corticales que surgen de la pre-bifurcación son llamadas ramos precoces, que corresponden a los ramos frontales y temporales del segmento M1.
Según Tanriover N y Kawashima M,55 de los 159 especímenes analizados, 90% de ellas presentaban los ramos temporales, y 30% presentaban los ramos frontales. De acuerdo con Türe et al.,56 el segmento M1, en 38 de los 40 hemisferios, dio origen de una a tres arterias corticales, que se localizaban, en la mayoría de las veces (75,8%) lateralmente a este segmento, irrigando al lóbulo temporal. Las arterias corticales pueden originarse también de la región medial (24,2%), vascularizando el lóbulo frontal. En siete hemisferios, pequeñas arterias corticales fueron encontradas irrigando la corteza piriforme.57
Las variaciones de los ramos corticales pueden ser clasificadas en cuatro tipos (A, B, C y D), de acuerdo con la región del segmento M1 de donde ellas se originan. Tipo A, ese segmento da origen solamente a ramos corticales temporales (laterales) pudiendo variar en número de uno a tres ramos temporales, siendo el más común la presencia de apenas un ramo. En el tipo B, el segmento M1 origina ramos temporales y ramos frontales (mediales).
Este tipo, la variación más encontrada es el origen de un ramo temporal y de un ramo frontal, pero puede ser visto también dos ramos temporales y un ramo frontal. En el tipo C, el segmento M1 da origen solamente a ramos frontales. E el tipo D, los ramos corticales no se originan de ese segmente, solamente las arterias lenticuloestriadas laterales y arterias del uncus. De todos los tipos, el tipo A es el más común, y los de tipo C y D los más raros.
En relación a las arterias lenticuloestriadas laterales (LLAs), ellas se originan de la región ínfero-medial del segmento M1 y recorren la porción central y lateral de la región anterior de la substancia perforada. Ellas irrigan la substancia innominada, putamen, globo pálido, núcleo caudado, capsula interna, corona radiada y la porción lateral de la comisura anterior.
Las LLAs varían en número de 1 a 15, no habiendo relación directa con la longitud del segmento M1 y la cantidad presente de estas arterias. El origen de esas arterias puede variar, surgiendo generalmente de la región ínfero-medial del segmento M1. Entretanto, ellas pueden surgir de los ramos temporales y frontales, o de los troncos superior e inferior del segmento M2, las LLAs no se comunican con el espacio subaracnoideo.
Segmento M2
El segmento M2 se origina en el limen de la ínsula, donde ocurre la bifurcación principal de la arteria cerebral media o, en algunos casos, de la trifurcación. Distalmente a la rodilla, los troncos superior e inferior emiten ramos que recorren a la ínsula hasta el surco peri-insular, donde marca el inicio el segmento M3. Esos ramos son llamados de troncos arteriales, de donde son originados las arterias corticales.
Los ramos del segmento M2 pueden originarse, de los troncos superior e inferior, del tronco intermediario, del ramo precoz o mismo de la arteria cerebral media accesoria.
Los ramos del tronco superior irrigan los giros transverso, accesorio y giros cortos de la ínsula, al ápex insular y el surco limitante anterior de la ínsula. Los ramos del tronco inferior irrigan los giros largos posteriores de la ínsula, el surco limitante interior y el limen de la ínsula.
Los ramos precoces se originan próximo a la bifurcación o de la trifurcación y irrigan cualquier parte de la ínsula, con excepción al surco central. Ellos irrigan parte del surco limitante inferior y anterior y limen de la ínsula. La arteria cerebral media accesoria es la variación más común de la arteria cerebral media. Tiene su origen en la arteria cerebral anterior y termina en la región orbito-frontal. Irriga los giros accesorio y transverso y al surco limitante anterior.
Las arterias corticales totalizan en número de 12 arterias y lanzan ramos para la ínsula, excepto la arteria temporo-polar. Ellas son: órbito-frontal, pre-frontal, pre-central, central, parietal anterior, parietal posterior, angular, temporo-occipital, temporal posterior, temporal media, temporal anterior y artería temporo-polares. Las arterias corticales del segmento M2 pueden originarse del tronco superior o del tronco inferior.
Es en el tronco superior donde tienen origen la mayoría de las arterias corticales, saliendo normalmente cinco arterias del tronco superior, que varía de dos a siete. Del tronco inferior, puede salir de dos a ocho arterias. Sin embargo, en los pacientes que presentan una trifurcación, el tronco intermediario también pueden dar origen a las arterias corticales, variando de una a dos.
Las arterias corticales que se originan del tronco superior generalmente recorren un camino más corto en la ínsula si son comparados con los de la arteria del tronco inferior. A parte de eso, ellas acostumbran a surgir más próximo de la bifurcación, alrededor del polo de la ínsula. La primera arteria cortical del tronco superior generalmente es la orbitofrontal, seguida por la prefrontal, precentral, central, parietal anterior, parietal posterior, angular y arterias temporo-occipitales. Las arterias parietal anterior, central, temporal-occipital y la angular, raramente originándose del tronco interior.
Del tronco inferior, surgen las arterias corticales que pasar por el giro largo de la ínsula y por el límite interior del surco e irriga la porción posterior de la ínsula. Sus primeros ramos más frecuentes son el temporal medio y el posterior, seguido del temporal anterior, parietal posterior y arterias temporo-polares.
Segmento M3
El inicio del segmento M3 es marcado por los surcos peri insulares anterior, superior e inferior y recorre el trayecto que va hasta la superficie medial del opérculo, o sea, en la superficie de la incisura silviana, donde se inicia el segmento M4. En su curso, el segmento M3 corre paralelamente al M2, irrigando la superficie medial del opérculo. En algunos casos, son segmento M3 pode dar origen a una o dos arterias pequeñas, que son responsables por irrigar los surcos peri insulares superior e inferior.
Una particularidad de las arterias órbito-fronto-laterales y la temporo-polar que puede presentarse es que se originen del segmento M1 y luego se extiendan como segmento M3, sin emitir ninguna rama para la ínsula.
Segmento M4
El segmento M3 recorre lateralmente la incisura silviana, saliendo de ella se transforma en segmento M4. Este segmento no origina ningún ramo para la ínsula, no tiene ningún papel en su vascularización.
La ínsula es predominantemente irrigada por los ramos del segmento M2.
Nuestras observaciones fueron semejantes a los de estudios previos. Según Ugur Türe y M. Gazi Yasargil,(56) cerca de 75 a 104 arterias originan se de ese segmento. En 55% de los hemisferios cerebrales analizados, fue observado el origen de una a seis arterias del segmento M1, los mismos son responsables por vascularizar principalmente el limen de la ínsula. En 10% de los hemisferios, el segmento M3 da origen a una o dos arterias, cuya función es irrigar los surcos peri-insulares superior e inferior. Aproximadamente, 80 a 90% de las arterias insulares son cortas y vascularizan al córtex insular y la cápsula extrema; 10% son mediana y son responsables de irrigar al claustrum y a la cápsula externa; y los 3 a 5% restantes son largas y alcanzan la corona radiata. Estas últimas están localizadas principalmente en la región posterior de la ínsula.
El putamen, globo pálido y cápsula interna son vascularizados por las LLAs. Esta región esta irrigada por las LLAs y está separada de la región irrigada por las arterias insulares por la cápsula externa. Del punto de vista de la vascularización de los surcos y de los giros de la ínsula, cada uno de ellos también poseen una irrigación particular por los ramos de las arterias insulares. En cuanto a la vascularización de los giros de la ínsula, el patrón es el siguiente: los giros accesorio y transverso reciben sangre de las arterias corticales del tronco superior. La arteria orbitofrontal es la única que vasculariza ambos los giros, excepto la pre-frontal, que también la vasculariza con una menor contribución. El giro corto anterior es irrigado por los ramos del tronco superior y por la arteria pre-frontal. El giro corto medio es vascularizado por los ramos del tronco superior y por la arteria precentral, que viene seguida por la pre-frontal. El ápice da insulsa recibe sangre de las arterias corticales del tronco superior y de las arterias prefrontal y precentral. El giro corto posterior recibe ramos del tronco superior y arteria central, que es acompañada por las arterias precentral y parietal anterior. El surco central y giro largo anterior son la única región de la ínsula que es vascularizado por los ramos del tronco superior como del tronco inferior en el mismo porcentaje siendo así llamada de zona de vascularización mixta. El surco central todavía recibe sangre de las arterias central y parietal anterior. El giro largo anterior es irrigado también por las arterias parietales anterior y posterior. El giro largo posterior es nutrido por los ramos del tronco inferior, que son responsables de vascularizar ese giro en 80% de los hemisferios. Las arterias angular y tempo-occipital irrigan exclusivamente ese giro.
En cuanto a la vascularización de los surcos limitantes (o circulares) de la ínsula el padrón es el siguiente. El surco circular anterior recibe sangre de los ramos del tronco superior y de las arterias órbitofrontal y prefrontal. Éstas vascularizan exclusivamente ese surco. El surco limitante inferior recibe ramos de los troncos inferiores en 80% de los hemisferios y de los ramos precedentes en 50% de los hemisferios. Es irrigado también por las arterias temporo-occipital y temporal posterior. Pueden ser encontradas en ese surco las arterias perforadas, principalmente en su región posterior. La región del limen es vascularizada predominantemente por la porción inicial del tronco inferior en más del 80% de los hemisferios y recibe contribución de los ramos precozmente en un tercio de los hemisferios. La arteria temporal media es responsable por la vascularización en 30% de los hemisferios, emitiendo más ramos para el limen de la ínsula de que para el tronco inferior.
Relaciones venosas
El sistema venoso de la ínsula presenta numerosas variaciones y asimetrías. Entretanto, existen algunas generalidades. El sistema venoso superficial drena el área cortical superficial de la cisura silviana, y el sistema venoso profundo drena la ínsula.
Entre esos dos sistemas, varias anastomosis son encontradas. El sistema venoso superficial es representado por la vena silviana superficial. Ella corrresponde a la vena más larga que drena el ramo posterior de la cisura silviana. La vena silviana superficial generalmente se origina como un único tronco. Algunas veces, ella puede originarse también como dos troncos, que se juntan antes de drenar para el seno venoso esfenoparietal generalmente.
El drenado de la vena silviana superficial ocurre, en 85% de los casos, para el seno esfenoparietal. En el resto de los casos puede drenar para el seno cavernoso o para el seno esfenopetroso.
Las venas que drenan las regiones a lo largo del ramo posterior de la incisura silviana reciben el nombre de acuerdo con la porción que ellas drenan. La vena de la región frontal es llamada fronto-silviana, de la parietal, parieto-silviana y de la temporal, temporo-silviana. La vena silviana superficial recibe generalmente seis venas fronto-silvianas, cuatro parieto-silvianas y cinco temporo-silvianas.
La vena de la región frontal es llamada fronto-sylviana; de la parietal, parieto-sylviana; y de la temporal, temporo-sylviana. Ellas drenan también parte de los giros cortos anterior y posterior, del giro largo anterior y de los surcos, central, precentral y del surco circular anterior. También, en 80% de los hemisferios, ellas drenan el giro corto medio y el ápice de la ínsula. Las venas fronto-silvianas, en la mayoría de los hemisferios, drenan para la vena silviana superficial.
Entretanto, en los hemisferios en los cuales no drenan para esa vena, ellas se vacían en la vena de Trolard que confluye para el seno sagital superior. Ellas hacen más anastomosis con las venas insulares que con las venas parieto-sylviana y temporo-sylviana.
Las venas parieto-silvianas acostumbran a drenar el giro poscentral y el lóbulo parietal inferior. En los hemisferios, contribuyen también en el drenado del giro largo anterior y del surco insular central. Ellas se vacían en la vena silviana superficial o en las venas que entra en el seno sagital superior, prácticamente con la misma frecuencia.
Las venas temporo-silvianas drenan una porción mayor de que las venas fronto-silvianas y parieto-silvianas, correspondiendo un área que va desde el polo temporal hasta la parte posterior final de la incisura lateral. Ellas contribuyen también en el drenado venoso del giro largo posterior y del límite inferior del surco. En 15% de los hemisferios, ellas drenaron para la vena silviana superficial. Y en el resto, ellas se vaciaron tanto en la vena silviana superficial como en la vena de Labbé.
La ínsula es drenada principalmente por el sistema venoso profundo, el cual ésta representado por las venas insulares y por la vena cerebral media profunda. Entre tanto, en algunas áreas, ella puede ser drenada por las tributarias de la vena silviana superficial.
Las venas insulares desembocan predominantemente en la vena cerebral media profunda. Éstas, tienen anastomosis con la vena silviana superficial en la mayoría de los hemisferios estudiados.
Segund Tanriover y col.,55 el drenado de la ínsula puede ser clasificada en tres grupos, de acuerdo con el sistema venoso para el cual el área de la ínsula drena: superficial, profundo y de transición. El grupo clasificado como de transición drena tanto para el sistema venoso superficial como para el sistema venoso profundo, drenando predominantemente al primero. El grupo que drena para el sistema venoso profundo corresponde al área del limen, surco circular inferior, giros largos y surco central. El sistema venoso superficial drena principalmente el giro corto medio y el ápice da ínsula. La zona de transición incluye el giro corto anterior y posterior, y el límite anterior del surco.
Las venas insulares reciben el nombre de acuerdo con el área que ellas drenan: anterior, precentral, central y posterior.
a vena cerebral media profunda, formando parte del sistema venoso profundo, es formada por la unión de las venas insulares en el área del limen. Son generalmente las venas insulares anteriores, precentral, centrales y posteriores que hacen parte de la formación del tronco transverso común.
DISCUSIÓN
La ínsula, o también llamada isla de Reil, es considerada un lóbulo cerebral que durante su desarrollo no evoluciono, siendo recubierta por los lóbulos frontal, temporal y parietal. Ella es visualizada separando los labios del surco lateral (surco de Silvio). Es una estructura de forma cónica que se encuentra recubriendo el clastrum y el putamen.
Sus funciones todavía no están claras y elucidadas. Se cree que la ínsula forma parte del sistema paralímbico y pueda tener funciones viscerales, motoras y sensoriales; y acción sobre las áreas motora, vestibular y del lenguaje.2,5,6,10
Ella también puede ejercer un papel importante sobre la función cardíaca, arritmias y regulación hormonal.5,12,17,21
La ínsula se torna una región anatómicamente importante a ser estudiada por ser un local posible de patologías, como tumores, malformaciones vasculares, infarto y hemorragias cerebrales; siendo así, esencial el conocimiento sobre la vascularización de esta área para la realización de cirugías.47,51,52,55-57,62-66
Relaciones anatómicas
La ínsula es una porción invaginada del córtex cerebral, localizada en la base de la incisura silviana. Se encuentra recubierta lateralmente por los opérculos fronto-orbital, fronto-parietal y temporal. Una vez que la cisura Silviana es abierta, los giros insulares se vuelven claramente visibles. Constituye la parte invaginada del córtex cerebral, que abarca el claustro y los ganglios de la base y hacen parte del bloque central (ínsula, núcleos de la base, capsula interna y tálamo), siendo su escudo externo.47
La irrigación arterial es realizada a partir de la arteria cerebral media y el drenado venoso es realizado por intermedio de la vena cerebral profunda. También, ella se relaciona con las arterias lentículo-estriadas laterales y ganglios basales.
Pequeños ramos oriundos del segmento M2 realizan la irrigación de sangre necesaria para la ínsula y tumores insulares. La mayoría de las arterias insulares no irán después del claustro, por lo tanto, ellas pueden ser sacrificadas durante la cirugía. Existen, algunos vasos frecuentemente originados por los ramos M2 más posteriores que también realizan la irrigación a partes de la cápsula interna.56,57 Daños a lo largo de esos vasos perforantes pueden ser una causa para déficit postoperatorio (hemiparesia) debido al compromiso de la pierna posterior de la cápsula interna.42,57 Moshel et al.,42 determinaron la posición de las arterias lenticuloestriadas por medio de la utilización de angiografía en el preoperatorio para evaluar si estos vasos estaban dislocados medialmente por la fase medial del tumor insular o si estaban en el interior del tumor.
Pacientes con tumores insulares que estaban situados lateralmente a las ALLss obtuvieron mejores resultados neurológicos y una mayor ocurrencia de resección total de que aquellos con tumores que se extienden medial a las LLAs. En nuestra serie la simple localización de tumor con padrón infiltrativo por encima de la substancia perforada anterior contraindica la resección del componente tumoral en esta topografía.
De acuerdo con Yasargil, el cirujano debe estudiar, explorar y focalizar con precisión todos los aspectos da cisura Silviana antes de iniciar la disección de ésta. A la información recogida sobre las variaciones de la cisura silviana y de la cisterna silviana, estas pueden ser útiles, exigiendo un ajuste de estrategia quirúrgica y de abordaje en cada caso particular.62-66
Funciones de la ínsula
Como parte del mesocórtex o sistema paralímbico, la ínsula conecta el allocortex al neocortex.33 A causa de las numerosas conexiones con los ganglios de la base, cápsula interna, tálamo, sistema límbico y neocórtex, varias funciones son acreditados a la ínsula, entre tanto una función más precisa permanece desconocida.5 Con varias conexiones neurales, la ínsula es considerada al mismo tiempo una zona visceral sensorial con conexiones desde las áreas motoras primarias y complementares, hasta el sistema vestibular, somato-sensorial, auditivo y áreas del lenguaje. La ínsula puede ser asociada a la memoria, conducción, afectividad y comportamiento.5 En cuanto a las divisiones de la ínsula, la ínsula anterior decodifica informaciones relativas a la representación del cuerpo y experiencias emocionales, y procesa estímulos olfativos y gustativos. La ínsula posterior, procesa la información relativa al dolor, temperatura y tacto.5 Duffau et al.5,9-11 relataron la ocurrencia de anartria o anomia cuando el córtex insular dominante fue estimulado en cinco pacientes durante la cirugía insular de glioma de bajo grado.9
La anatomía microquirúrgica del lóbulo de la ínsula y su estudio por el método tridimensional trae una visión más realista sobre las relaciones neurales y vasculares de esta región. La correlación anatómica con las cirugías de tumores en esta región es una importante herramienta para la evaluación de esta anatomía distorsionada por la enfermedad.
BIBLIOGRAFÍA
- Beez T, Boge K, Wager M, Whittle I, Fontaine D, Spena G, et al. Tolerance of awake surgery for glioma: a prospective European Low Grade Glioma Network multicenter study. Acta Neurochir (Wien). 2013;155(7):1301-8. PMID 23689968.
- Bertani G, Fava E, Casaceli G, Carrabba G, Casarotti A, Papagno C, et al. Intraoperative mapping and monitoring of brain functions for the resection of low-grade gliomas: technical considerations. Neurosurg Focus. 2009;27(4):E4. PMID 9795953.
- Claus EB, Horlacher A, Hsu L, Schwartz RB, Dello-Iacono D, Talos F, et al. Survival rates in patients with low-grade glioma after intraoperative magnetic resonance image guidance. Cancer. 2005;103(6):1227-33. PMID 15690327.
- Duffau H, Capelle L, Lopes M, Bitar A, Sichez JP, van Effenterre R. Medically intractable epilepsy from insular low-grade gliomas: improvement after an extended lesionectomy. Acta Neurochir (Wien). 2002;144(6):563-72; discussion 572-3. PMID 12111489.
- Duffau H, Capelle L, Lopes M, Faillot T, Sichez JP, Fohanno D. The insular lobe: physiopathological and surgical considerations. Neurosurgery. 2000;47(4):801-10; discussion 810-1. PMID 11014418.
- Duffau H, Capelle L, Sichez N, Denvil D, Lopes M, Sichez JP, et al. Intraoperative mapping of the subcortical language pathways using direct stimulations. An anatomo-functional study. Brain. 2002;125(Pt 1):199-214. PMID 11834604.
- Duffau H, Denvil D, Capelle L. Absence of movement disorders after surgical resection of glioma invading the right striatum. J Neurosurg. 2002;97(2):363-9. PMID 12186465.
- Duffau H, Mandonnet E. The “onco-functional balance” in surgery for diffuse low-grade glioma: integrating the extent of resection with quality of life. Acta Neurochir (Wien). 2013;155(6):951-7. PMID 23447053.
- Duffau H, Moritz-Gasser S, Gatignol P. Functional outcome after language mapping for insular World Health Organization Grade II gliomas in the dominant hemisphere: experience with 24 patients. Neurosurg Focus. 2009;27(2):E7. PMID 19645563.
- Duffau H. A personal consecutive series of surgically treated 51 cases of insular WHO Grade II glioma: advances and limitations. J Neurosurg. 2009;110:696-708. PMID 19133753.
- Duffau H. Diffuse low-grade gliomas and neuroplasticity. Diagn Interv Imaging. 2014;95(10):945-55. PMID 25218490.
- Duffau H. Surgical neurooncology is a brain networks surgery: a "connectomic" perspective. World Neurosurg. 2014;82(3-4):e405-7. PMID 23416775.
- Duffau H. The conceptual limitation to relying on intraoperative magnetic resonance imaging in glioma surgery. World Neurosurg. 2014;82(5):601-3. PMID 24636939.
- Duffau H. The dangers of magnetic resonance imaging diffusion tensor tractography in brain surgery. World Neurosurg. 2014;81(1):56-8. PMID 23376386.
- Ebeling U, Kothbauer K. Circumscribed low grade astrocytomas in the dominant opercular and insular region: a pilot study. Acta Neurochir (Wien). 1995;132(1-3):66-74. PMID 7754861.
- Fernández-Miranda JC, de Oliveira E, Rubino PA, Wen HT, Rhoton AL Jr. Microvascular anatomy of the medial temporal region: part 1: its application to arteriovenous malformation surgery. Neurosurgery. 2010;67(3 Suppl Operative):ons237-76; discussion ons276. PMID 20679924.
- Gil Robles S, Gatignol P, Capelle L, Mitchell MC, Duffau H. The role of dominant striatum in language: a study using intraoperative electrical stimulations. J Neurol Neurosurg Psychiatry. 2005;76(7):940-6.
- Guenot M, Isnard J, Sindou M. Surgical anatomy of the insula. Adv Tech Stand Neurosurg. 2004;29:265-88. PMID 15035341.
- Hentschel SJ, Lang FF. Surgical resection of intrinsic insular tumors. Neurosurgery. 2005;57(1 Suppl):176-83; discussion 176-83. PMID 15987586.
- Isnard J, Guénot M, Ostrowsky K, Sindou M, Mauguière F. The role of the insular cortex in temporal lobe epilepsy. Ann Neurol. 2000;48(4):614-23. PMID 11026445.
- Isolan G, Antunes AC, Dini LI, Stefani MA, Costa CR, Frizon L, et al. Gliomas insulares: aspectos gerais. J Bras Neurocir. 2008;19:7-13.
- Isolan GR, Bianchin MM, Bragatti JA, Torres C, Schwartsmann G. Musical hallucinations following insular glioma resection. Neurosurg Focus. 2010;28(2):E9. PMID 20121444.
- Isolan GR, de Aguiar PH, Aires R, Meister CS, Stefani MA. Middle cerebral artery “pseudotetrafurcation”: anatomic report and review of middle cerebral artery variations. Neurosurg Q. 2010;20(4):284-7.
- Isolan GR, de Aguiar PH. Artéria carótida externa e seus ramos – anatomía microcirúrgica. In: Tahara A, Antunes AC, Isolan GR, de Aguiar PH, editors. Tratamento neurocirúrgico das doenças vasculares do SNC. São Paulo: Di Livros; 2012. p. 1-12.
- Isolan GR, de Aguiar PH. Artérias infratentoriais - anatomia microcirúrgica. In: Tahara A, Antunes AC, Isolan GR, de Aguiar PH, editors. Tratamento neurocirúrgico das doenças vasculares do SNC. São Paulo: Di Livros; 2012. p. 35-44.
- Isolan GR, de Aguiar PH. Artérias supratentoriais - anatomia microcirúrgica. In: Tahara A, Antunes AC, Isolan GR, de Aguiar PH, editors. Tratamento neurocirúrgico das doenças vasculares do SNC. São Paulo: Di Livros; 2012. p. 13-34.
- Isolan GR, Oliveira Ed, Recalde R. [Microanatomical study of the choroidal fissure in ventricular and cisternal approaches]. Arq Neuropsiquiatr. 2005;63(3B):801-6. PMID 16258659.
- Isolan GR, Pereira AH, de Aguiar PH, Antunes AC, Mousquer JP, Pierobon MR. Anatomia microcirúrgica da artéria carótida externa: um estudo estereoscópico. J Vasc Bras. 2012;11(1):3-11.
- Isolan GR, Pereira AH, de Aguiar PH, Antunes AC, Mousquer JP, Peirobon MR. Anatomia microcirúrgica das artérias infratentoriais: um estudo estereoscópico. J Vasc Bras. 2012;11(2):114-22.
- Isolan GR. A construção do conhecimento pelo jovem neurocirurgião: ética, ciencia e a importância do treinamento em laboratório de microcirurgia. J Bras Neurocirurg. 2009;20(3):314-34.
- Ius T, Pauletto G, Isola M, Gregoraci G, Budai R, Lettieri C, et al. Surgery for insular low-grade glioma: predictors of postoperative seizure outcome. J Neurosurg. 2014;120(1):12-23. PMID 24236654.
- Iwasaki M, Kumabe T, Saito R, Kanamori M, Yamashita Y, Sonoda Y, et al. Preservation of the long insular artery to prevent postoperative motor deficits after resection of insulo-opercular glioma: technical case reports. Neurol Med Chir (Tokyo). 2014;54(4):321-6. PMID 24140777.
- Kalani MY, Kalani MA, Gwinn R, Keogh B, Tse VC. Embryological development of the human insula and its implications for the spread and resection of insular gliomas. Neurosurg Focus. 2009;27(2):E2. PMID 19645558.
- Karnofsky D, Burchenal JH. The clinical evaluation of chemotherapeutic agents in cancer. In: MacLeod CM, editor. Evaluation of chemotherapeutic agents. New York: Columbia University Press; 1949. p. 191-205.
- Kawaguchi T, Kumabe T, Saito R, Kanamori M, Iwasaki M, Yamashita Y, et al. Practical surgical indicators to identify candidates for radical resection of insulo-opercular gliomas. J Neurosurg. 2014;121(5):1124-32. PMID 25127416.
- Keles GE, Lamborn KR, Berger MS. Low-grade hemispheric gliomas in adults: a critical review of extent of resection as a factor influencing outcome. J Neurosurg. 2001;95(5):735-45. PMID 11702861.
- Kombos T, Süss O, Vajkoczy P. Subcortical mapping and monitoring during insular tumor surgery. Neurosurg Focus. 2009;27(4):E5. PMID 19795954.
- Krayenbühl N, Isolan GR, Hafez A, Yaşargil MG. The relationship of the fronto-temporal branches of the facial nerve to the fascias of the temporal region: a literature review applied to practical anatomical dissection. Neurosurg Rev. 2007;30(1):8-15; discussion 15. PMID 17096156.
- Lang FF, Olansen NE, DeMonte F, Gokaslan ZL, Holland EC, Kalhorn C, et al. Surgical resection of intrinsic insular tumors: complication avoidance. J Neurosurg. 2001;95(4):638-50. PMID 11596959.
- Mandonnet E, Capelle L, Duffau H. Extension of paralimbic low grade gliomas: toward an anatomical classification based on white matter invasion patterns. J Neurooncol. 2006;78(2):179-85. PMID 16739029.
- Mandonnet E, Delattre JY, Tanguy ML, Swanson KR, Carpentier AF, Duffau H, et al. Continuous growth of mean tumor diameter in a subset of grade II gliomas. Ann Neurol. 2003;53(4):524-8. PMID 12666121.
- Moshel YA, Marcus JD, Parker EC, Kelly PJ. Resection of insular gliomas: the importance of lenticulostriate artery position. J Neurosurg. 2008;109(5):825-34. PMID 18976071.
- Neuloh G, Pechstein U, Schramm J. Motor tract monitoring during insular glioma surgery. J Neurosurg. 2007;106(4):582-92. PMID 17432707.
- Ojemann GA, Whitaker HA. Language localization and variability. Brain Lang. 1978;6(2):239-60. PMID 728789.
- Oldfield RC. The assessment and analysis of handedness: the Edinburgh inventory. Neuropsychologia. 1971;9(1):97-113. PMID 5146491.
- Ribas GC, Bento RF, Rodrigues AJ Jr. Anaglyphic three-dimensional stereoscopic printing: revival of an old method for anatomical and surgical teaching and reporting. J Neurosurg. 2001;95(6):1057-66. PMID 11765824.
- Ribas GC, Oliveira Ed. [The insula and the central core concept]. Arq Neuropsiquiatr. 2007;65(1):92-100. PMID 17420835.
- Ribas GC, Yasuda A, Ribas EC, Nishikuni K, Rodrigues AJ Jr. Surgical anatomy of microneurosurgical sulcal key points. Neurosurgery. 2006;59(4 Suppl 2):ONS177-210; discussion ONS210-1. PMID 17041489.
- Robles SG, Gatignol P, Lehéricy S, Duffau H. Long-term brain plasticity allowing a multistage surgical approach to World Health Organization Grade II gliomas in eloquent areas. J Neurosurg. 2008;109(4):615-24. PMID 18826347.
- Roper SN, Lévesque MF, Sutherling WW, Engel J Jr. Surgical treatment of partial epilepsy arising from the insular cortex. Report of two cases. J Neurosurg. 1993;79(2):266-9. PMID 8331411.
- Sanai N, Polley MY, Berger MS. Insular glioma resection: assessment of patient morbidity, survival, and tumor progression. J Neurosurg. 2010;112(1):1-9. PMID 19612970.
- Simon M, Neuloh G, von Lehe M, Meyer B, Schramm J. Insular gliomas: the case for surgical management. J Neurosurg. 2009;110(4):685-95. PMID 19099379.
- Stummer W, Pichlmeier U, Meinel T, Wiestler OD, Zanella F, Reulen HJ. Fluorescence-guided surgery with 5-aminolevulinic acid for resection of malignant glioma: a randomised controlled multicentre phase III trial. Lancet Oncol. 2006;7(5):392-401. PMID 16648043.
- Taillandier L, Duffau H. Epilepsy and insular Grade II gliomas: an interdisciplinary point of view from a retrospective monocentric series of 46 cases. Neurosurg Focus. 2009;27(2):E8. PMID 19757989.
- Tanriover N, Rhoton AL Jr, Kawashima M, Ulm AJ, Yasuda A. Microsurgical anatomy of the insula and the sylvian fissure. J Neurosurg. 2004;100(5):891-922. PMID 15137609.
- Türe U, Yaşargil DC, Al-Mefty O, Yaşargil MG. Topographic anatomy of the insular region. J Neurosurg. 1999;90(4):720-33. PMID 10193618.
- Türe U, Yaşargil MG, Al-Mefty O, Yaşargil DC. Arteries of the insula. J Neurosurg. 2000;92(4):676-87. PMID 10761659.
- Vanaclocha V, Sáiz-Sapena N, García-Casasola C. Surgical treatment of insular gliomas. Acta Neurochir (Wien). 1997;139(12):1126-34; discussion 1134-5. PMID 9479418.
- Wen HT, Rhoton AL Jr, de Oliveira E, Cardoso AC, Tedeschi H, Baccanelli M, et al. Microsurgical anatomy of the temporal lobe: part 1: mesial temporal lobe anatomy and its vascular relationships as applied to amygdalohippocampectomy. Neurosurgery. 1999;45(3):549-91; discussion 591-2. PMID 10493377.
- Wen HT, Rhoton AL Jr, de Oliveira E, Castro LH, Figueiredo EG, Teixeira MJ. Microsurgical anatomy of the temporal lobe: part 2--sylvian fissure region and its clinical application. Neurosurgery. 2009;65(6 Suppl):1-35; discussion 36. PMID 19934983.
- Wolf BS, Huang YP. The insula and deep middle cerebral venous drainage system: normal anatomy and angiography. Am J Roentgenol Radium Ther Nucl Med. 1963;90:472-89. PMID 14076037.
- Yasargil MG, Krisht AF, Türe U, Al-Mefty O, Yaşargil DC. Microsurgery of insular gliomas: Part II - Opening of the Sylvian Fissure. Contemp Neurosurg. 2002;24(12):1-5.
- Yasargil MG, Krisht AF, Türe U, Al-Mefty O, Yaşargil DC. Microsurgery of insular gliomas: Part III - Pathophysiology and Clinical Presentation. Contemp Neurosurg. 2002;24(13):1-5.
- Yasargil MG, Krisht AF, Türe U, Al-Mefty O, Yaşargil DC. Microsurgery of insular gliomas: Part IV - Surgical Treatment and Outcome. Contemporary Neurosurgery. 2002;24(14):1-8.
- Yaşargil MG, von Ammon K, Cavazos E, Doczi T, Reeves JD, Roth P. Tumours of the limbic and paralimbic systems. Acta Neurochir (Wien). 1992;118(1-2):40-52. PMID 1414529.
- Yasargil MG. Microneurosurgery. Vol 4. New York: Thieme Medical; 1996.
- Zentner J, Meyer B, Stangl A, Schramm J. Intrinsic tumors of the insula: a prospective surgical study of 30 patients. J Neurosurg. 1996;85(2):263-71. PMID 8755755.
