Título
rol de DTI y estimulación de tractos
Autor
Fecha
Lugar de Realización
Correspondencia
Texto
REV ARGENT NEUROC. VOL. 33, N° 2: 73-81. 2019
NOTA TÉCNICA
Nuevos conceptos en neuromodulación cerebral:
rol de DTI y estimulación de tractos
Javier Angel Toledo1,3, Patricio Donnelly Kehoe3,4, Guido Pascariello3,4, Mauricio Chamorro2,
Pablo Mortarino3, Tomás De La Riestra2, Jose Carlos Nallino1,3, Jorge Mandolesi5
1Servicio de Neurocirugía, Sanatorio Parque, Rosario, Argentina
2Servicio de Movimientos Anormales, INECO Grupo Oroño, Rosario Argentina
3Servicio de Neurocirugía, Hospital Clemente Alvarez, Rosario, Argentina
4Instituto CIFASIS, CONICET, Rosario, Argentina
5Servicio de Neurocirugía, Fundación Favaloro, Bs. As., Argentina
RESUMEN
Introducción: La estimulación cerebral profunda es una técnica difundida y validada para eltratamiento de múltiples dolencias neurológicas y psiquiátricas, entre ellas el temblor esencial.
Objetivo: Evaluar si existe un correlato clínico-anatómico, para un paciente con TE, entre la mejor estimulación lograda y los tractos involucrados. Para esto se realiza una descripción de la técnica utilizada, incluyendo el procesamiento de imágenes necesario.
Material y métodos: Se presenta el caso de un paciente de 53 años de edad, con una historia de 23 años de temblor esencial progresivo e incapacitante. Se realizó un implante de DBS bilateral en Vim. Se realizó un post procesamiento de imágenes con un método desarrollado por nuestro equipo a través del cual se permitió evaluar gráficamente el área de estimulación cerebral y sus relaciones con los tractos implicados en la patología (dento-rubro-talámico, haz piramidal y haz lemniscal).
Resultados: El paciente presentó una mejoría del 55% medido por escala de temblor de Tolosa. Se obtuvo una correlación anatómica y funcional de lo esperado según imágenes y la respuesta clínica del paciente. Se constataron efectos adversos cuando la estimulación implicaba fibras del haz piramidal y lemniscal, presentando los mejores efectos clínicos cuando el haz dento-rubro-talámico era influenciado por el área de acción del campo eléctrico.
Conclusiones: En este reporte mostramos la aplicabilidad de DTI y tractografía para explicar los efectos de la programación de los pacientes con estimulación cerebral profunda.
Palabras Claves: DTI; Neuromodulación; Tractografía; DBS; Temblor Esencial
ABSTRACT
Introduction: Deep brain stimulation is a widespread and validated technique for the treatment of multiple neurological and psychiatric disorders, including essential tremor.
Objective: To evaluate if there is a clinical-anatomical correlate, for a patient with essential tremor, between the best stimulation achieved and the tracts involved. For this, a description of the technique used is made, including the necessary image processing.
Methods: We present the case of a 53-year-old patient with a 23-year history of progressive and disabling essential tremor. A bilateral DBS implant was performed on Vim. We performed a post-processing of images with a method developed by our team through which we were able to graphically evaluate the area of brain stimulation and its relationships with the tracts involved in the pathology (dento-rubro-thalamic tract, pyramidal tract and lemniscal tract).
Conclusions: In this report we showed the applicability of DTI and tractography to explain the clinical effects of the programming features in patients with deep brain stimulation.
Key Words: DTI; Neuromodulation; Tractography; DBS; Essential Tremor
Javier A. Toledo
jtoledo@live.com.ar
Recibido: Abril de 2019.
Aceptado: Junio de 2019.
INTRODUCCIÓN
La estimulación cerebral profunda (DBS del inglés Deep Brain Stimulation) es una técnica difundida y validada para el tratamiento de múltiples dolencias neurológicas y psiquiátricas. Desde sus inicios en los años ‘50, su posterior refinamiento en los ‘80 y hasta la actualidad, miles de pacientes se han beneficiado con esta modalidad de tratamiento3,10. A pesar de que las bases fisiológicas de la neuroestimulación continúan sin aclararse en su totalidad, son varias las teorías propuestas al respecto. Las primeras lo relacionaron a un efecto símil lesión, en donde la función inhibitoria tenía un rol preponderante5. Hoy en día se acepta la noción de que la modulación se ejerce sobre una red cerebral más amplia y no sólo sobre el núcleo estimulado directamente, teniendo efectos anterógrados, retrógrados y espaciales en distintos puntos de la red11.
Dentro del abanico de patologías tratadas con DBS, el temblor esencial (TE) ha demostrado ser tratado satisfactoriamente convirtiéndose en una indicación formal para casos intratables con medicación. Entre los clásicos blancos de estimulación en esta enfermedad, se encuentran el núcleo intermedio-ventral (Vim) del tálamo, región posterior del subtálamo (pSTN) y región caudal de Zona Incerta (cZI). Todos estos puntos se encuentran en íntima relación espacial con el haz dento-rubro-talámico2,26,27.
El haz dento-rubro-talámico (DRT) es el principal tracto que forma el pedúnculo cerebeloso superior, el cual constituye una de las conexiones eferentes más largas del cerebelo. Consiste principalmente en fibras axónicas que parten desde células localizadas en los núcleos dentado, emboliforme y globoso. De acuerdo con la descripción anatómica clásica, las fibras conforman haces compactos que ascienden dorso-lateralmente al cuarto ventrículo. La mayoría de estas fibras se decusan a nivel de la protuberancia y entran en el núcleo rojo contralateral. Una minoría de fibras que emergen del núcleo dentado terminan en el núcleo rojo. La mayoría de las fibras se proyectan al tálamo y terminan en el núcleo ventral-oralis posterior (VOP) y ventralis intermedio (Vim)8,20. Estos núcleos luego proyectan, entre otras regiones, a la corteza motora primaria. Dada estas relaciones, no es de extrañar el gran interés de su estudio en el tratamiento del TE. Con el advenimiento de nuevas tecnologías en imágenes y la capacidad de análisis de las mismas, se han desarrollado métodos no invasivos para el estudio de los mecanismos subyacentes a la estimulación12.
Imágenes por difusión y tractografía
Las imágenes ponderadas por difusión (DWI del inglés Diffusion Weighted Images), son una modalidad de resonancia magnética (RMI) sensible al movimiento del agua en los tejidos. Dado que el movimiento del agua en la materia gris, en la materia blanca o en el líquido cefalorraquídeo es diferente, es posible utilizar estas imágenes para obtener información relacionada con la microestructura del tejido nervioso. Las DWI son principalmente utilizadas para el estudio de la materia blanca y la conectividad estructural del cerebro.
El análisis de la información adquirida con esta modalidad se realiza utilizando modelos físicos de la difusión del agua. Existen múltiples modelos, pero el más usado en la clínica médica es el Modelo de Tensor de Difusión que utiliza un tensor matemático (que puede ser interpretado geométricamente como un elipsoide) a partir del cual se derivan las llamadas Imágenes por Tensor de Difusión (DTI del inglés Diffusion Tensor Imaging).
Las DTI permiten estudiar la anisotropía del tejido, es decir, el movimiento direcc ional del agua a lo largo de los axones. La anisotropía fraccional (FA del inglés Fractional Anisotropy) es una variable numérica cuyos valores oscilan entre 0 (máxima isotropía, tal como la observada en espacios subaracnoideos y ventrículos normales, donde el agua se moviliza libremente) y 1 (máxima anisotropía por restricción en el movimiento del agua tisular)28. Adicionalmente, ajustando el tensor de difusión en cada voxel de la DWI es posible reconstruir un modelo estimativo de la distribución de las fibras nerviosas en el cerebro, conocido usualmente como t ractografía, la cual permite estudiar la conectividad estructural del cerebro in-vivo, a pesar de ser solo una aproximación con múltiples limitaciones20.
Conectómica
La conectómica es un novel campo de investigación cuyo objetivo es crear mapas cerebrales a múltiples niveles, desde neuronas individuales a redes completas y comprender cómo estas estructuras dan lugar a una función compleja del cerebro17. La naturaleza dinámica de un sistema complejo no puede ser entendida a través de pensar el mismo como la suma de elementos independientes (Ej: entender el cerebro a través del conocimiento de sus neuronas individuales). Por lo contrario, un nuevo acercamiento al estudio es necesario para poder dar explicación a fenómenos emergentes. Es así que conexiones funcionales, aún sin una correlación estructural, pueden darse a través de conexiones indirectas, y es posible a través de la conectividad funcional cambiar la dinámica cerebral aun manteniendo constante la organización de la red9. Estos preceptos sientan las bases fisiológicas para poder explicar los resultados complejos que se obtienen con la estimulación cerebral profunda.
Estimulación de fibras blancas
En el área de la neurocirugía funcional clásica, las lesiones y posteriormente la estimulación, fueron dirigidas a núcleos grises del cerebro, esto fue así en virtud de la pobre posibilidad de localización de fibras blancas con las técnicas antiguas y la falta de conocimiento de la conectómica cerebral. A pesar de esto, ya en 1965, Landau se interesó en el estudio de la estimulación cerebral, demostrando que el efecto sobre los tractos blancos era mayor que sobre los cuerpos neuronales22. Desde esos entonces numerosos estudios han contribuido a la noción de que los axones son los actores principales de la estimulación eléctrica6,15,23. Dado el cuerpo creciente de evidencia que implican a la materia blanca como objetivos de estimulación, se podría hipotetizar que el direccionamiento de la estimulación a partir de imágenes de DTI podrían proveer un nivel de eficacia igual o mayor al alcanzado con las técnicas clásicas.
OBJETIVOS
En el tratamiento con DBS para TE existen reportes que sugieren que es la estimulación del haz DTR la que ejerce el mayor efecto sobre el alivio de los síntomas8. El objetivo del presente artículo es evaluar si existe un correlato clínico-anatómico, para un paciente con TE, entre la mejor estimulación lograda y los tractos involucrados (incluyendo el DTR). Para esto se realiza una descripción de la técnica utilizada, incluyendo el post procesamiento de imágenes necesario.
MATERIALES Y MÉTODOS
Un paciente de 53 años de edad, diestro, arquitecto y docente universitario fue referido a nuestro servicio por una historia de 23 años de temblor de intención en la mano derecha que progresa contralateralmente de forma paulatina, posterior a situaciones de estrés. El temblor se agrava en situaciones de tensión emocional y cansancio. La prueba del alcohol fue positiva al principio, pero con una progresión en el tiempo. Inició tratamiento medicamentoso con propanolol hasta dosis de 40 mg, el cual debió suspender por bradicardia (dosis menores sin efecto sobre el temblor). Como en ese momento no se contaba con primidona en el vademecum local, se prueba con gabapentin sin mejoría. Se indica Levetiracetam hasta 3000 mg con leves beneficios clínicos, medicación que debió ser suspendida por ilusiones visuales. Se indica topiramato en combinación con Primidona (ya disponible en este momento para su uso comercial) con mejoría del temblor, pero sin llegar a desarrollar sus actividades de la vida cotidiana con normalidad por la persistencia de los síntomas.
Se le ofrece al paciente realizar una implantación bilateral de electrodos para estimulación cerebral profunda. La escala de Fahn-Tolosa-Marin para temblor fue aplicada pre y post operatoriamente (3 meses) para dar una medida objetiva de mejoría.
Adquisición de imágenes
Una semana previa a la cirugía se realizó una RMI sin marco de estereotaxia y sin necesidad de sedación. La adquisición de las imágenes de RMI fueron realizadas en un resonador Phillip Achieva 3T. El protocolo incluyó:
I. Imagen 3D T2;
II. Imagen 3D FLAIR;
III. Imagen 3D T1 con contraste;
IV. Imágenes pesadas por difusión (DWI) de alta resolución y 32 direcciones.
Los detalles técnicos de las secuencias son:
I. La secuencia anatómica ponderada en T2, 3D, voxel isométrico (1x1x1 [mm3]), FOV: 240x240x179 [mm3], TR=7.5 ms, TE=3.6 [ms], FLIP= 8 [deg], adquisición anteroposterior;
II. La secuencia anatómica FLAIR con supresión SPIR, voxel isométrico (1x1x1 [mm3]), FOV: 250x250x202 [mm3], Matriz=252x251x202 [slices], Gap=0[mm], orientación de slice sagital, TR=4800 ms, TE=294 [ms], FLIP= 40 [deg], adquisición anteroposterior;
III. La secuencia 3D T1 con contraste tiene la misma configuración que la T2;
IV. una secuencia EPI, ponderada por difusión, adquirida en 32 dirección no co-planares con b=100 y una imagen B0 al inicio, voxel=2.5x2.5x2.5 [mm3], FOV=230x230x150 [mm3], Matriz=92x90x60 [slices], Gap=0 [mm], orientación del slice transversal, TE=82 [ms], TR=6700 [ms], Flip=90 [deg], adquisición anteroposterior.
Las imágenes de tomografía pre-operatorias y post-operatoria fueron adquiridas en un equipo de 8 canales (Bright Speed 8, General Electric Healthcare Technologies, Waukesha, USA). Con cortes volumétricos de 1.2mm cada 1.2mm sin gap.
Procedimiento estereotáctico
Un marco de estereotaxia (Fime - Blue Frame, Córdoba, Argentina) fue montado bajo anestesia local. Luego de la adquisición de las imágenes tomográficas, las mismas fueron cargadas en el sistema MNPS 10.36.03 de planificación estereotáctica (MEVIS Informática Médica Ltda.). El blanco en el Vim fue planeado con una trayectoria tal que se evitaran vasos, surcos y ventrículos laterales. El paciente fue posicionado en la camilla de cirugía en una posición semi-sentado. Bajo anestesia local se insertaron bilateralmente tres microelectrodos sobre un microdrive (Stardrive FHC) para el registro de la actividad eléctrica cerebral. Posterior a la macro-estimulación y eligiendo la trayectoria con mejor respuesta terapéutica y sin efectos indeseables, se realizó el implante de los electrodos definitivos (Medtronic modelo 3389), bajo visión fluoroscópica. Luego de retirar el marco de estereotaxia y bajo anestesia general, se realizó la colocación subcutánea -subclavicular derecha del generador (Medtronic - Activa PC). Programación La programación inicial del sistema se realizó a las 3 semanas postoperatorias, bajo el protocolo standard de inicio, constando de una prueba de contactos buscando la máxima estimulación soportada sin efectos adversos.
Métodos de procesamiento de la imagen de referencia anatómica (3D T1)
Las imágenes estructurales fueron procesadas mediante el software FreeSurfer (v6.0) para segmentar tejidos y regiones subcorticales y corticales13. De forma breve el procesamiento de FreeSurfer, que se resume en la figura 1, consiste en:
- Preprocesamiento en el cual se homogeneizan las intensidades entre cortes, se corrigen las inhomogeneidades del campo y se extraen los tejidos que no pertenecen al sistema nervioso central;
- Segmentación, en el cual se delimitan los principales tejidos, materia gris (MG) y materia blanca (MB) y además se segmentan las estructuras subcorticales usando técnicas de morfometría basada en vóxeles;
- Normalización de Intensidad, en la cual se utiliza la información de la segmentación para corregir de forma más rigurosa las intensidades de la imagen;
- Segmentación de la materia blanca, en la que se segmenta la MB con el fin de encontrar la superficie en la cual empieza la MG;
- Modelado de la corteza cerebral, en la cual se utiliza el límite de la MB y la superficie cerebral para modelar la corteza;
- Registración a un atlas esférico, en la cual se utiliza la información de surcos y circunvoluciones generadas a partir del modelo de la corteza cerebral para hacer coincidir los principales surcos con un atlas promedio, este paso es fundamental, ya que en el mismo no se tratan de hacer coincidir los cerebros, sino que se usa únicamente la distribución de los principales surcos para la identificación de las áreas funcionales y de los lóbulos; y
- Parcelación cortical en la cual se usa el atlas esférico para delimitar las principales áreas cerebrales a nivel de corteza, pudiéndose a partir de ello extraer volúmenes, espesores, curvaturas y otra información estructural relevante de cada región. Este procesamiento permite dividir al sistema nervioso central en sus partes constitutivas en el espacio nativo, de manera de poder demarcar de forma sistemática regiones específicas. Además es posible utilizar las regiones demarcadas en el espacio anatómico de alta resolución para estudiar el comportamiento global en otras modalidades e integrar así la segmentación con la tractografía.
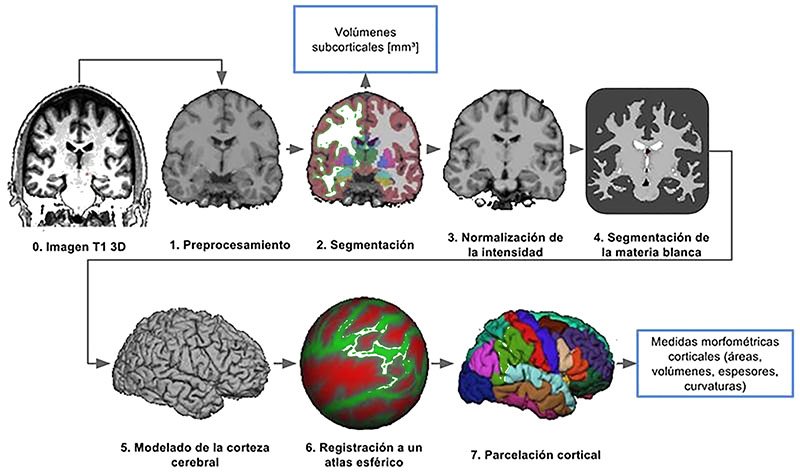
Figura 1: Procesamiento estructural de RMI. Resumen de los pasos implicados en el procesamiento estructural.
Métodos de procesamiento de imágenes pesadas por difusión (DWI)
En la figura 2 se resumen los pasos y tecnologías utilizadas para el procesamiento de las DWI. En este caso, por tratarse de imágenes de 32 direcciones se utilizó únicamente el modelo tensor de difusión1. En la figura 1 se omitieron los pasos del preprocesamiento, los cuales incluyeron la remoción de artefactos relacionados a las corrientes de Foucault, al movimiento y a inhomogeneidades del campo magnético.
En la figura 2 se muestran en cursiva los paquetes de software utilizados para cada paso y los datos implicados. La generación de tractos contó con tres procesos principales:
I. Modelo tensor de difusión (DT), en el cual se utilizan las 32 direcciones para modelar el movimiento del agua en cada voxel utilizando un elipsoide;
II. Semilleo, en el cual se determina el espacio de materia blanca a partir de la segmentación anatómica y se genera un número de semillas a partir de los cuales se iniciarán los tractos graficados; y
III: Tracking, donde a partir de cada semilla se unen las direcciones de cada voxel con el fin de obtener fibras1. Para todos estos pasos se desarrolló un software propio utilizando mayormente el paquete Dipy de Python14. Para la visualización de los resultados y la segmentación de tractos específicos se registró toda la información proveniente de las múltiples modalidades al espacio DWI utilizando el paquete FSL y se visualizó utilizando el software TrackVis4.
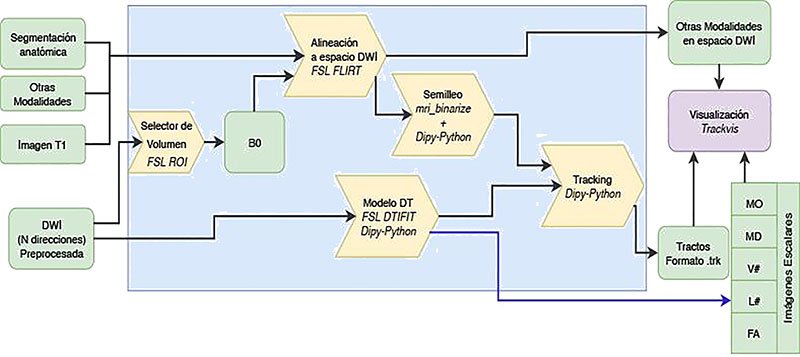
Figura 2: Procesamiento de DWI. Método para el procesamiento de DWI. En la Figura se ha omitido el pre-procesamiento para focalizar el procedimiento en la obtención de los tractos. Las abreviaciones de la Figura hacen referencia a: i) B0 es la imagen de difusión sin ponderación por dirección (T2 3D rápida); ii) Modelo DT se refiere al Modelo Tensor de Difusión; iii) Tracking al proceso de reconstrucción de tractos; iv) MO se refiere a la medida de Moda, MD a la difusividad media; V# a los autovectores; L# a los autovalores y FA a la fracción de anisotropía, todas imágenes escalares derivadas del modelo Modelo Tensor de Difusión.
Método de estudio de la conectividad implicada en la estimulación profunda
Para este estudio se individualizaron tres tractos: haz medio-lemniscal (ML), haz DTR y haz piramidal (HP). La elección de los mismos se decidió en función de su relación directa con la estimulación espacial y funcional en él TE. El trazado de las fibras del haz DRT comenzó con un volumen de interés (VOI) esférico localizado sobre el núcleo dentado sobre la RMI en su secuencia T1 y Flair. De las fibras resultantes se tomaron aquellas que atravesaban el pedúnculo cerebeloso superior con un segundo VOI. Finalmente, se trazó un tercer VOI en las fibras blancas del giro precentral (a partir de la segmentación automática de corteza y sustancia blanca). Como detalle final de este tracto, se excluyeron del mismo todas aquellas fibras que se dirigieran hacia la corteza y sustancia blanca del giro postcentral. Se obtuvo también con fines de completar el estudio de la zona y los tractos intervinientes en la estimulación, el haz piramidal tomando como VOI el mesencéfalo en su totalidad y un segundo VOI en el giro precentral. El haz leminiscal medial fue obtenido con el mismo VOI en mesencéfalo y un segundo volumen en el giro post-central.
Con el fin de verificar la posición de los electrodos, fue necesario realizar una reconstrucción de los mismos lo más fidedigna posible. Este paso fue vital para poder ubicar tridimensionalmente los contactos que servirían luego de puntos de estimulación y su relación anatómica con el parénquima cerebral. Para tal fin, se utilizó un software automatizado (PaCER) de reconstrucción de electrodos cerebrales profundo, pudiendo guardar estos datos para, en una segunda etapa, estimar el volumen estimulado19. Se realizó un cálculo del Volumen de Activación Tisular (VAT) asistidos con el modelo matemático de Dembek incluido en el software Lead-DBS18.
RESULTADOS
El temblor en el paciente fue satisfactoriamente aliviado. En la escala de Faher-Tolosa se obtuvo una mejoría aproximadamente del 55%.
Tras realizar el test de contacto inicial (Tabla 1), se planeó una estrategia de estimulación en base a los resultados clínicos. Los mejores resultados se obtuvieron con los siguientes parámetros: electrodo izquierdo, polo 3 negativo (monopolar), 1.0 V, 130 Hz, 60 μs; electrodo derecho, polo negativo (monopolar), 0.5 V, 130 Hz, 60 μs. Se registraron las coordenadas de los polos de estimulación efectivos en relación a punto medio comisural en la Tabla 2.
| Contacto | Voltaje | Temblor* | Efectos Adversos |
| 0 | 1.5v | 2 | Parestesia en mano y pie |
| 1 | 1.5 | 1 | |
| 2.0v | EA | Parestesia en mano y pie (transitorio) | |
| 2.5v | EA | Parestesia facial | |
| 2 | 2 | 0 | |
| 2.5 | 0 | Disartria | |
| 3 | 2.5 | 0 | Disartria |
| 8 | 1.5 | 0 | Parestesia permanente en cara, brazo y pierna |
| 9 | 1.5 | 0 | |
| 2.5 | EA | Disartria | |
| 10 | 2 | 1 | |
| 2.5 | EA | Disartria | |
| 11 | 1.5 | EA | Disartria |
Tabla 2: coordenadas del electrodo en función del punto medio-comisural
| Lat | AP | Vert | |
| IZQ | -10 | -5.5 | 1.2 |
| DER | 11.2 | -5.8 | 0.5 |
La fusión post-operatoria de la tomografía y la proyección sobre uno de los atlas anatómico preinstalado en el paquete Lead-DBS (Horn 2017) revela la localización exacta del electrodo y de la relación espacial respecto al Vim. Se observa que el electrodo izquierdo se encuentra a 0.8 mm del núcleo en sentido antero-posterior. No obstante, cuando se calcula el VAT, este lo incluye parcialmente. Por su parte el electrodo derecho se encuentra atravesando el núcleo y completamente incluido en el VAT (fig. 3).

Figura 3: Trayectoria de electrodos en función de la localización del punto óptimo de estimulación del Vim (verde) en el Altas (Horn 2017). Se observa una clara estimulación del Vim derecho, mientras que el electrodo izquierdo tiene una influencia anatómica más bien a través de su volumen de activación. ED: Electrodo Derecho, EI: Electrodo Izquierdo
En un segundo análisis relacionando la estimulación con las fibras blancas incluidas en nuestro estudio se encontraron que todas ellas (ML, DRT y HP) se encuentran en el ámbito de influencia de ambos electrodos.
Al evaluar el VAT correspondiente a los parámetros con los que mejor respuesta terapéutica se aportaba al paciente, se observó una estimulación directa del haz DTR, correlacionándose clínicamente con la aparición de efectos adversos al aumentar la intensidad y llegando a tener influencia sobre el tracto piramidal. Se correlacionó adecuadamente los resultados clínicos con los efecto de la estimulación con ambos electrodos. En el hemisferio derecho, como se puede observar en las imágenes (figs. 4 y 5), el VAT se encuentra tomando fibras del HP, comenzando a producir disartria como efecto adverso. Así mismo, notamos cómo el electrodo izquierdo se haya anatómicamente próximo al haz ML y con bajas intensidades de estimulación obtienen parestesias principalmente, sin ocasionar alteraciones motoras (figs. 4 y 5).
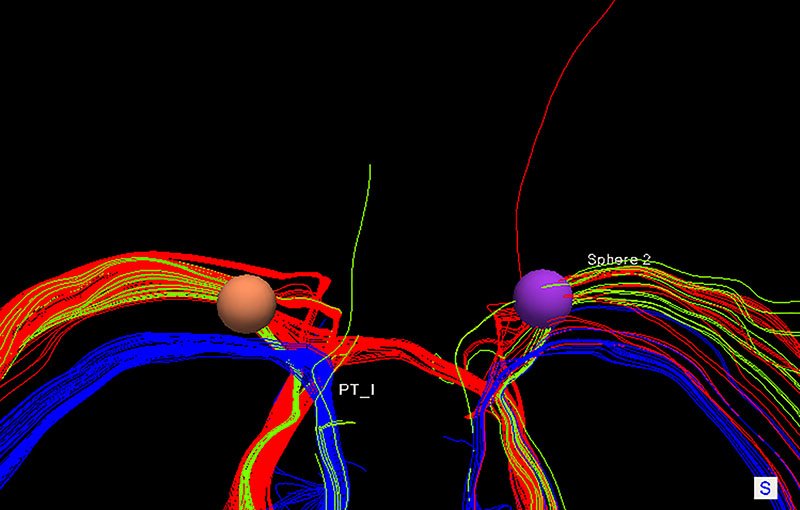
Figura 4: Correlación entre el VAT y los haces estudiados en una visión superior estricta. Verde: DRT, Rojo: HP, Azul: LM
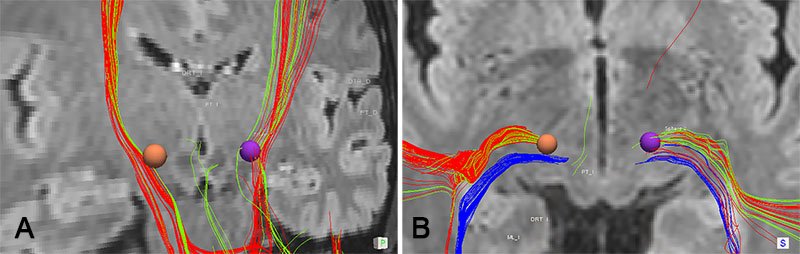
Figura 5: Relación del VAT estimado con los haces en proyección con el parénquima adyacente. a) visión posterior ilustrando el haz DTR (verde) y HP (rojo). b) Visión superior con los tres tractos en estudio. Es notable la relación directa del área estimulada con el DRT con una mínima cantidad de fibras estimuladas.
DISCUSIÓN
La estimulación cerebral profunda es, hoy en día, el gold standard para el tratamiento de Enfermedad de Parkinson, temblor esencial y distonía entre otras patologías complejas del SNC25. La evolución de esta técnica estereotáxica se ve aparejada con los avances en la adquisición de neuroimágenes y en su procesamiento. Existen una variedad de herramientas de procesamiento, ya sea en el circuito comercial como en el académico. En nuestro grupo, hemos trabajado en el desarrollo del análisis de neuroimágenes con softwares abiertos y globalmente disponibles con el fin de poder reproducir modelos publicados obteniendo resultados similares. La introducción del DTI y tractografía como método de verificación, estimula la exploración fisiológica de los efectos subyacentes a la estimulación, en nuestro caso, en TE.
El haz DRT se encuentra en relación directa con el control del temblor como se ha documentado por diversos autores16,21. Plaha et al. han sugerido que el control del temblor se logra a bajos voltajes en la región subtalámica posterior (pSTN) posiblemente por la afección del DTR en una zona profunda donde el mismo cruza la pSTN o la parte caudal de la ZI26,27. Nuestros hallazgos muestran una concordancia con esta hipótesis.
Esto se relaciona correctamente en nuestro análisis con la distancia de los polos de estimulación al DRT. Gracias a la estimación matemática del VAT en función de la impedancia del tejido y parámetros de estimulación pudimos verificar estas presunciones objetivamente.
En un análisis de efectos adversos encontramos, que, en la estimulación de ambos electrodos, con los contactos más cefálicos, se obtienen alteraciones motoras y disartria al reclutar en la estimulación, fibras del haz piramidal y leminisco medial. Dado que ambos electrodos del caso se encuentran dentro del blanco planeado (± 0.5mm), y estos concuerdan con los planeamientos clásicos del Vim para temblor esencial, es interesante tener en cuenta la localización de los tractos para, tal vez, modificar en futuros caso el blanco del electrodo con el fin de incluir en su área de estimulación el DRT, alejándonos del ML y HP. Este ejercicio realizado para él TE, se podría reproducir para Enfermedad de Parkinson con sus distintos blancos con el fin de obtener mejores resultados clínicos y aportando evidencia al conocimiento fisiológico de las conexiones cerebrales y su relación a la estimulación eléctrica.
Es de plantearse a partir de la evidencia, nuevos blancos para la estimulación cerebral, en donde se valoren más las conexiones cerebrales en función de los tractos afectados, y no los cuerpos neuronales representados por los núcleos grises. Este planteo aplicado ya publicado por Coenen en 2011, tiene algunas limitaciones7. Por un lado, la reproducibilidad de la reconstrucción de los tractos abordados. Existen múltiples formas de realizar la reconstrucción de los mismos. Como ejemplo, recientemente se han descrito al menos cuatro maneras de obtener el haz DTR, todas ellas basadas en ROIs localizados manualmente24. De esta manera se deja en manos del analista, los detalles de la obtención de este tracto. En parte, para subsanar de alguna forma, esta fuente de variabilidad y sesgo, nuestro grupo ha desarrollado un proceso semi-automatizado de tractografía a partir de la segmentación automática de sustancia gris y sustancia blanca. Esto permite liberarnos de una gran fuente de error humano. Una segunda limitación a esta propuesta es la resolución espacial que se puede lograr con el DTI. Coenen ha demostrados con RMI 1.5T que la precisión con la que se puede hallar un tracto específico ronda los 3 mm7.
Con el avance de las neurociencias y de las herramientas de procesamiento de información hemos podido realizar cirugías cada vez más seguras y eficientes. Gracias al aporte en conjuntos con las diferentes disciplinas y aprovechando estos avances pudimos realizar un ejercicio de estudio fisiológico in-vivo en nuestro paciente con TE, llegando a los mejores efectos clínicos posibles y con la explicación científica de los efectos subyascentes.
CONCLUSIONES
En este reporte mostramos la aplicabilidad de DTI y tractografía para explicar los efectos de la programación de los pacientes con estimulación cerebral profunda. En futuros estudios se plantea utilizar los tractos efectivos como blancos directos en la colocación de los electrodos combinando imágenes de alta resolución de RMI y de CT, en conjunto con una batería de post procesamiento de imágenes con un trabajo en conjunto de médicos, bioingenieros, físicos e informáticos.
BIBLIOGRAFÍA
1. Alexander AL, Lee JE, Lazar M, Field AS. Diffusion tensor imaging of the brain. Neurotherapeutics 2007; 4:316–329. Available: http://dx.doi.org/10.1016/j.nurt.2007.05.011.
2. Benabid AL, Pollak P, Gao D, Hoffmann D, Limousin P, Gay E, et al. Chronic electrical stimulation of the ventralis intermedius nucleus of the thalamus as a treatment of movement disorders. Journal of Neurosurgery 1996;203–214. Available: http://dx.doi.org/10.3171/jns.1996.84.2.0203.
3. Benabid AL, Pollak P, Louveau A, Henry S, de Rougemont J. Combined (thalamotomy and stimulation) stereotactic surgery of the VIM thalamic nucleus for bilateral Parkinson disease. Appl. Neurophysiol. 1987; 50:344–346.
4. Benner T, Wang R, Van Wedeen J. Diffusion Tensor Imaging of the Brain. Parallel Imagingin Clinical MR Applications 2007;379–392. Available: http://dx.doi.org/10.1007/978-3-540- 68879-2_34. 288.
5. Butson CR, Cooper SE, Henderson JM, McIntyre CC. Patient-specific analysis of the volume of tissue activated during deep brain stimulation. Neuroimage 2007; 34:661–670.
6. Coenen VA, Fromm C, Kronenbürger M, Rohde I, Reinacher PC, Becker R, et al. Electrophysiological proof of diffusion-weighted imaging-derived depiction of the deep-seated pyramidal tract in human. Zentralbl. Neurochir. 2006; 67:117–122.
7. Coenen VA, Allert N, Mädler B. A role of diffusion tensor imaging fiber tracking in deep brain stimulation surgery: DBS of the dentato-rubro-thalamic tract (drt) for the treatment of therapy-refractory tremor. Acta Neurochir. 2011; 153:1579–85; discussion 1585.
8. Damoiseaux JS, Greicius MD. Greater than the sum of its parts: a review of studies combining structural connectivity and resting-state functional connectivity. Brain Structure and Function 2009; 213:525–533. Available: http://dx.doi.org/10.1007/s00429-009-0208-6.
9. Delgado JMR, Hamlin H, Chapman WP. Technique of Intracranial Electrode Implacement for Recording and Stimulation and its Possible Therapeutic Value in Psychotic Patients. Stereotactic and Functional Neurosurgery 1952; 12:315–319. Available: http://dx.doi.org/10.1159/000105792.
10. Dostrovsky JO, Lozano AM. Mechanisms of deep brain stimulation. Movement Disorders 2002; 17:S63–S68. Available: http://dx.doi.org/10.1002/mds.10143.
11. Driver J, Blankenburg F, Bestmann S, Vanduffel W, Ruff CC. Concurrent brain-stimulation and neuroimaging for studies of cognition. Trends Cogn. Sci. 2009; 13:319–327.
12. Fischl B. FreeSurfer. NeuroImage 2012; 62:774–781. Available: http://dx.doi.org/10.1016/j.neuroimage.2012.01.021.
13. Garyfallidis E, Brett M, Amirbekian B, Rokem A, van der Walt S, Descoteaux M, et al. Dipy, a library for the analysis of diffusion MRI data. Front. Neuroinform. 2014; 8:8.
14. Gradinaru V, Mogri M, Thompson KR, Henderson JM, Deisseroth K. Optical deconstruction of parkinsonian neural circuitry. Science 2009; 324:354–359.
15.Growdon JH, Chambers WW, Liu CN. AN EXPERIMENTAL STUDY OF CEREBELLAR DYSKINESIA IN THE RHESUS MONKEY. Brain 1967; 90:603–632. Available: http://dx.doi.org/10.1093/brain/90.3.603.
16. Henderson JM. “Connectomic surgery”: diffusion tensor imaging (DTI) tractography as a targeting modality for surgical modulation of neural networks. Front. Integr. Neurosci. 2012; 6:15.
17. Horn A, Kühn AA. Lead-DBS: a toolbox for deep brain stimulation electrode localizations and visualizations. Neuroimage 2015; 107:127–135.
18. Husch A, V Petersen M, Gemmar P, Goncalves J, Hertel F. PaCER - A fully automated method for electrode trajectory and contact reconstruction in deep brain stimulation. Neuroimage Clin 2018; 17:80–89.
19. Jones DK, Knösche TR, Turner R. White matter integrity, fiber count, and other fallacies: The do’s and don'ts of diffusion MRI. NeuroImage 2013; 73:239–254. Available: http://dx.doi.org/10.1016/j.neuroimage.2012.06.081.
20. Krystkowiak P, Martinat P, Cassim F, Pruvo J-P, Leys D, Guieu J-D, et al. Thalamic tremor: Correlations with three-dimensional magnetic resonance imaging data and pathophysiological mechanisms. Movement Disorders 2000; 15:911–918. Available: 3.0.co;2- b.">http://dx.doi.org/10.1002/1531-8257(200009)15:5<911::aid-mds1023>3.0.co;2-b.
21. Landau WM, Bishop GH, Clare MH. SITE OF EXCITATION IN STIMULATION OF THE MOTOR CORTEX. Journal of Neurophysiology 1965; 28:1206–1222. Available: http://dx.doi.org/10.1152/jn.1965.28.6.1206.
22. McIntyre CC, Grill WM, Sherman DL, Thakor NV. Cellular effects of deep brain stimulation: model-based analysis of activation and inhibition. J. Neurophysiol. 2004; 91:1457– 1469.
23. Nowacki A, Schlaier J, Debove I, Pollo C. Validation of diffusion tensor imaging tractography to visualize the dentatorubrothalamic tract for surgical planning. J. Neurosurg. 2018;1–10.
24. Perlmutter JS, Mink JW. Deep brain stimulation. Annu. Rev. Neurosci. 2006; 29:229–257.
25. Plaha P, Khan S, Gill SS. Bilateral stimulation of the caudal zona incerta nucleus for tremor control. J. Neurol. Neurosurg. Psychiatry 2008; 79:504–513.
26. Plaha P, Patel NK, Gill SS. Stimulation of the subthalamic region for essential tremor. Journal of Neurosurgery 2004;48–54. Available: http://dx.doi.org/10.3171/jns.2004.101.1.0048.
27. Romero C, Ghisi JP, Mazzucco J, Ternak A. Imágenes con tensor de difusión en resonancia magnética. Rev. Argent. Neurocirugia 2007; 21:49–52.
COMENTARIO
El artículo muestra la experiencia lograda en un caso que fue intervenido quirúrgicamente para colocación de DBS (Deep Brain Stimulation) en Temblor Esencial, agregando el uso de post-procesamiento de imágenes con DTI (imágenes por tensor de difusión), y así generando mapas de tractos de sustancia blanca en la cercanía del área estimulada, con el objetivo de optimizar los parámetros de estimulación. Resulta interesante la utilidad de la definición de este mapa para demostrar y, eventualmente, predecir la aparición de efectos adversos de la estimulación. Es importante destacar el uso de software de postprocesamiento de imágenes gratuito, que también aplicamos en cirugía de epilepsia, y esperamos que progresivamente se instale su uso generalizado en nuestro país, aún desde etapas tempranas de la formación neuroquirúrgica.
Existen descripciones previas de esta metodología, aplicada a cirugía de DBS para diferentes patologías, donde se plantea la necesidad de contar con estudios randomizados controlados1,2, para demostrar la eficacia del método, no solo para la evaluación postoperatoria del paciente, sino inclusive para la estrategia de planeamiento prequirúrgico en la colocación de los electrodos. Al ser un método accesible y no invasivo, esperamos que la cantidad de casos en los que se aplique sea cada vez mayor.
Federico Sánchez González
Hospital de Clínicas de la Universidad de Buenos Aires. C.A.B.A.
- Calabrese E. Diffusion Tractography in Deep Brain Stimulation Surgery: A Review. Front Neuroanat. 2016;10:45. Published 2016 May 2. doi:10.3389/fnana.2016.00045.
- See AAQ, King NKK. Improving Surgical Outcome Using Diffusion Tensor Imaging Techniques in Deep Brain Stimulation. Front Surg. 2017;4:54. Published 2017 Sep 28. doi:10.3389/fsurg.2017.00054.
COMENTARIO
En este interesante reporte de caso los autores nos presentan la utilidad de DTI y tractografía en la interpretacion de los posibles efectos de la ECP.
En primera instancia se destaca que estas técnicas proporcionan una nueva visión de la progamaciòn de blancos en en ECP, dada la comprensión que desarrollan del mencanismo de estimulación y las conexiones de las redes subcorticales, cambiando sustancialmente el paradigma de este tipo de cirugías.
Estas nuevas modalidades de adquisicion de parametros y datos permitieron el desarrollo de nuevas alternativas terapeuticas, que a pesar de la variabilidad interindividual y la reproductibilidad del método, surgen como elementos limitantes asociado a la necesidad de personal especializado para la interpretacion1.
Esta situación plantea un muy interesante punto de discusión, ya que si bien la utilización de metodos directos de selección de blancos ha probado ser efectiva en la supresión del temblor en los pacientes con temblor esencial2, los metodos indirectos, asociados al micro y semimicroregistro y la exploración semiologica presentan un impacto contundente en el control de la sintomatología3,4.
Ante esta problemática el planteo de que metodología utilizar es mandatorio.
En nuestra opinion personal, a pesar que los métodos directos de selección de blancos aun necesitan de estudios prospectivos y controlados para demostrar el beneficio de su uso, la utilización de estos, en conjunto con los indirectos, se muestran complementarios y de gran utilidad para el tratamiento de esta patología.
No obstante, en esta nueva era de la revolución de la imagen y la neuromodulación tendremos la tarea y el desafío de encontrar el justo equilibrio para balancear esta ecuación.
Sergio Pampin
Fabian Piedimonte
Fundacion CENIT. C.A.B.A.
BIBLIOGRAFÍA
- Chazen JL, Sarva H, Stieg PE, Min RJ, Ballon DJ, Pryor KO, Riegelhaupt PM, Kaplitt MG. Clinical improvement associated with targeted interruption of the cerebellothalamic tract following MR-guided focused ultrasound for essential tremor. J Neurosurg. 2018 Aug;129(2):315-323. doi: 10.3171/2017.4.JNS162803. Epub 2017 Oct 20.
- Nowacki A, Schlaier J, Debove I, Pollo C. Validation of diffusion tensor imaging tractography to visualize the dentatorubrothalamic tract for surgical planning. J Neurosurg. 2018 Mar 23;130(1):99-108. doi: 10.3171/2017.9.JNS171321.
- Pedrosa DJ, Brown P, Cagnan H, Visser-Vandewalle V, Wirths J, Timmermann L, Brittain JS. A functional micro-electrode mapping of ventral thalamus in essential tremor. Brain. 2018 Sep 1;141(9):2644-2654. doi: 10.1093/brain/awy192.
- Dallapiazza RF, Lee DJ, De Vloo P, Fomenko A, Hamani C, Hodaie M, Kalia SK, Fasano A, Lozano AM. Outcomes from stereotactic surgery for essential tremor. J Neurol Neurosurg Psychiatry. 2019 Apr;90(4):474-482. doi: 10.1136/jnnp-2018-318240. Epub 2018 Oct 18. Review.
